Se creuser la tête
3 Matière organique du sol
Sylvie Quideau; Myrna Simpson; and Adam Gillespie
OBJECTIFS D’APPRENTISSAGES
À la fin de ce chapitre, l’étudiant devrait être en mesure :
- de définir la matière organique du sol et énumérer ses principaux composants;
- d’évaluer l’influence de la matière organique sur les propriétés et processus physiques, chimiques et biologiques du sol;
- d’expliquer le cycle de renouvellement de la matière organique du sol (et d’en connaître l’origine);
- d’en savoir plus sur la distribution géographique de la matière organique du sol et sur sa gestion;
- d’évaluer d’un œil critique la façon dont la matière organique du sol est mesurée et quantifiée;
- de reconnaître l’importance du rôle que joue la matière organique du sol dans les enjeux globaux.
INTRODUCTION
Parce que la matière organique du sol est constituée de carbone et que le sol contient la grande majorité du carbone terrestre, il n’est pas étonnant qu’elle soit devenue un sujet d’actualité. En effet, le carbone contenu dans la matière organique du sol joue un rôle important dans le cycle mondial du carbone. En plus de servir de réservoir (stocks) de carbone, la matière organique du sol joue un rôle de premier plan dans le développement des propriétés du sol. De fait, elle influence pratiquement toutes les propriétés du sol, y compris celles qui déterminent sa structure physique, sa fertilité et même sa biodiversité. La santé globale d’un sol est tributaire de la présence de matière organique. La matière organique du sol est composée de résidus végétaux et animaux à divers stades de décomposition, de biomasse microbienne et de produits de synthèse microbienne. L’accumulation de matière organique dans un sol reflète l’équilibre entre les apports de litière végétale et les pertes par la respiration microbienne, l’érosion et le lessivage. Les stocks de carbone peuvent varier considérablement d’un sol à l’autre en fonction du gradient topographique au sein d’un paysage, du matériau géologique d’origine, du climat et de la végétation.
QU’EST-CE QUE LA MATIÈRE ORGANIQUE DU SOL ?
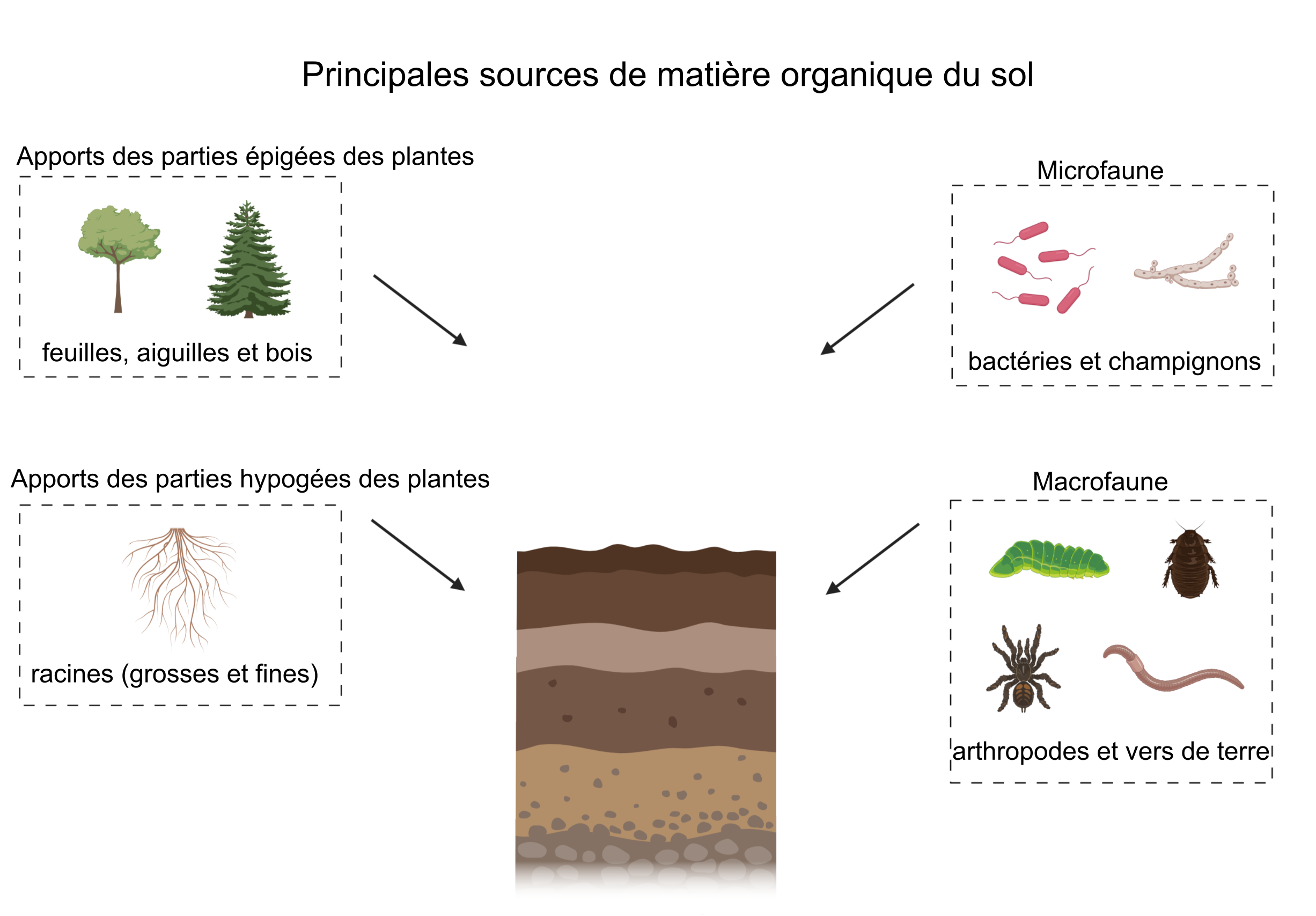
La matière organique du sol comprend à la fois une partie vivante et une partie non vivante. La partie vivante est constituée de la macro et microfaune du sol et des communautés microbiennes du sol, qui peuvent être actives ou en dormance. La partie non vivante de la matière organique présente dans un sol est constituée de la matière provenant des plantes et des animaux morts qui y a été incorporée (figure 3.1). Après avoir subi divers processus biogéochimiques, ces apports de matière organique peuvent être conservés, évacués ou conservés dans le sol mais sous une autre forme. Selon l’hypothèse actuelle, la partie non vivante de la matière organique du sol serait formée d’un mélange complexe de différentes molécules d’origine biologique qui se trouveraient dans le sol à divers stades d’oxydation et de conservation (Schmidt et al. 2011). La structure chimique de la matière organique du sol fait l’objet de débats depuis des décennies. On a longtemps pensé que la matière organique du sol était constituée de biomolécules et de substances humiques [reconnaissables], soit de composés résultant de la décomposition biologique et chimique de la matière organique d’origine végétale ou animale (Schmidt et al. 2011 ; Lehmann et Kleber, 2015 ; voir encadré 1 — Matière à réflexion). Or, une récente hypothèse fait part de la contribution essentielle des communautés microbiennes dans la formation de la matière organique du sol (Simpson et al. 2007). Durant le processus de décomposition, les microorganismes respirent la majorité du carbone présent dans les intrants organiques sous forme de CO2 ; une partie du carbone est incorporée dans la biomasse microbienne, du carbone peut également interagir avec des minéraux argileux ou il peut être partiellement dégradé dans le sol. En conséquence de quoi la matière organique du sol est constituée d’un mélange complexe de résidus végétaux, animaux ou microbiens à divers stades de décomposition et par de nouvelles molécules synthétisées par les microbes. La matière organique du sol peut également former des complexes organominéraux avec les minéraux du sol, ce qui contribue au phénomène d’agrégation du sol. Sous cette forme complexe, la matière organique gagne en stabilité car elle est protégée des microorganismes qui ne peuvent y accéder physiquement (Oades, 1988 ; Baldock et Skjemstad, 2000).
La matière organique joue plusieurs rôles clés dans les propriétés et les processus du sol. Sa présence améliore la stabilité du sol en favorisant l’agrégation, ce qui réduit du même coup le potentiel d’érosion du sol. Elle améliore également la rétention en eau du sol et possède une capacité d’échange cationique élevée (de 100 à 500 cmolc(+) kg-1) qui contribue à la capacité totale d’échange cationique du sol selon la quantité de matière organique présente dans le sol. Cela améliore la capacité du sol à retenir les cations importants (Ca2+, Mg2+, K+ et Na+), qui peuvent améliorer la capacité tampon du sol. De ce fait, la matière organique du sol agit comme un réservoir d’engrais capable de libérer lentement les éléments nutritifs des plantes, notamment l’azote, le phosphore et le soufre. De plus, elle nourrit une communauté faunique et microbienne importante et variée. La matière organique du sol est également la partie la plus « biogéochimiquement » active et dynamique de toutes les composantes du sol ; son importance est manifeste dans la régulation de nombreux processus liés au cycle global d’éléments tels que le carbone.
POURQUOI LA MATIÈRE ORGANIQUE DU SOL EST-ELLE SI IMPORTANTE ?
La matière organique du sol est intimement liée à de nombreuses propriétés physiques, chimiques et biologiques clés du sol. Elle est si importante pour les fonctions du sol qu’il est presque impossible de trouver une propriété du sol qui ne soit pas influencée par elle d’une manière ou d’une autre. Chaque chapitre du manuel fait référence à l’influence de la matière organique du sol sur l’expression globale des propriétés physiques, chimiques et biologiques du sol. Le tableau 3.1 montre l’importance que bon nombre de composantes du sol fournissent dans la production agricole et la part d’influence que la matière organique du sol exerce sur ces composantes. Dans bon nombre de ces cas, on constate à quel point les propriétés de la matière organique du sol permettent d’atténuer les conditions qui pourraient avoir un effet limitatif sur la croissance des plantes et d’accentuer les processus qui favorisent la croissance des plantes.
Eau du sol. La matière organique du sol a la capacité de tamponner l’approvisionnement en eau dans le sol. Il y a beaucoup d’eau qui s’infiltre dans un sol à teneur élevée en matière organique lors d’épisodes pluvieux intenses, ce qui a pour effet de limiter la formation de mares, la saturation des sols et les conditions anoxiques qui restreignent la croissance des plantes. La matière organique du sol a également la capacité de retenir l’eau en période de sécheresse et de déficit hydrique. Ensemble, ces deux phénomènes agissent pour stabiliser l’hydrodynamisme de l’alimentation en eau des plantes. Les sols sableux bénéficient de l’augmentation de la matière organique sur le plan hydrologique, car ils sont intrinsèquement secs en raison des grands espaces interparticulaires qui retiennent peu d’eau.
Structure et compaction du sol. L’agrégation du sol est un indicateur important d’une bonne structure du sol, car les agrégats permettent d’améliorer l’infiltration en eau ainsi que la colonisation du sol par les racines. En effet, la structure en agrégat (dite aussi granulaire) a tendance à se former dans les sols à forte teneur en matière organique, tandis que les sols présentant une structure polyédrique induite par l’aménagement des terres ont tendance à contenir moins de matière organique. La compaction, qui risque surtout de se produire dans les sols aménagés intensivement, peut être atténuée par des apports de matière organique, en particulier sa fraction dite particulaire ou « légère » (voir section Composition de la matière organique du sol). Enfin, les sols argileux peuvent être plus facilement exploités lorsque le taux de matière organique y est élevé, car cette dernière réduit la cohésion et la plasticité interparticulaire.
Statut nutritif du sol. La matière organique contient un large éventail de groupes fonctionnels qui peuvent augmenter la capacité d’échange cationique. En effet, elle peut contenir entre 50 et 90 % de la capacité d’adsorption des cations d’un sol. De plus, la matière organique du sol possède des réservoirs de macronutriments tels que l’azote, le phosphore et le soufre que les activités de minéralisation microbiennes rendent disponibles aux plantes.
Capacité d’échange cationique du sol. La matière organique du sol contribue à la capacité totale d’échange cationique du sol. La capacité d’échange cationique de la matière organique (CEC) varie de 100 à 500 cmolc(+) kg-1, ce qui est nettement plus élevée que la plupart des minéraux présents dans les sols. La CEC de la matière organique dépend grandement du pH : plus le pH augmente dans la solution de sol, plus les groupes fonctionnels se dissocient, libérant ainsi les cations. La capacité d’échange cationique d’un sol sert à retenir les éléments nutritifs importants, principalement les cations Ca2+, Mg2+, K+ et Na+ qui contribuent également à la capacité tampon du sol.
Biologie du sol et stockage d’énergie. Les liaisons chimiques dans la matière organique du sol recèlent un potentiel énergétique que les microorganismes exploitent pour leur croissance et leur métabolisme. C’est cette énergie stockée qui sert à alimenter le cycle des éléments nutritifs des microorganismes et toutes ces autres associations bénéfiques aux plantes que la biologie du sol entretient avec elles.
Tableau 3.1. Contribution de la matière organique du sol aux fonctions fondamentales du sol
| Fonction | Fonctions caractéristiques/processus | Effet de la matière organique du sol |
|---|---|---|
| Structure du sol | Stabilité des agrégats | Favorise la stabilité des agrégats |
| Compaction | La présence de matière organique particulaire aide à résister à la compaction | |
| Érosion | La stabilité des agrégats aide à réduire l’érosion | |
| Encroûtement | Aide à réduire les conditions préalables à la formation de croûtes (c.-à-d. érosion et destruction des agrégats) | |
| Cycle des éléments nutritifs | Accepter, retenir et libérer des cations | La capacité d’échange cationique (CEC) élevée de la matière organique du sol améliore la capacité du sol à retenir les cations basiques |
| Alimentation oxy-anion (N, P, S) | Les réservoirs (pools) de N, P et S stockés dans la matière organique sont une source de macronutriments que les activités de minéralisation microbiennes rendent disponibles aux plantes | |
| Réguler l’eau | Infiltration et rétention | Contribue au maintien de la stabilité et à la diversification des structures poreuses qui servent à recevoir, à emmagasiner et à libérer l’humidité pour répondre aux besoins des plantes |
| Alimentation en eau | Retenir adéquatement l’eau et sert à neutraliser et à réduire les effets de la sécheresse | |
| Tamponnage des événements de précipitations extrêmes | Réduire l’érosion et la formation de mares lors d’événements pluvieux extrêmes en offrant à l’eau des voies d’infiltration diverses | |
| Fonction microbienne | Diversité microbienne | Encourage la diversité des microorganismes par sa gamme de substrats qui vient répondre aux besoins de processus métaboliques tout aussi divers |
| Stocker et libérer (recycler) l’énergie | Constitue l’entrepôt primaire d’énergie chimique utilisée dans la respiration microbienne et le point de départ des cycles des principaux éléments nutritifs | |
| Favorise la croissance des plantes | La matière organique favorise la présence élevée de microorganismes qui à son tour peut exercer une action bénéfique sur les plantes en supprimant certains agents qui leur causent des maladies | |
| Milieu de croissance des plantes | Germination des graines et croissance des racines | Améliore l’humidification des graines et l’accès aux éléments nutritifs, réduit la pression physique exercée sur les racines en croissance |
| Neutralise l’acidité, la sodicité | Une CEC élevée peut neutraliser et réduire des propriétés chimiques indésirables | |
| Gestion des déchets | Séquestrer les éléments biotoxiques | Une CEC élevée peut réduire la mobilité des métaux |
| Dégrader les substances organiques | Soutient une population microbienne diversifiée qui peut dégrader les xénobiotiques |
D’OÙ VIENT LA MATIÈRE ORGANIQUE DU SOL ET POURQUOI PERSISTE-T-ELLE ?
Apports de carbone dans les sols
Différents apports en carbone peuvent être préservés ou modifiés par diverses réactions biologiques et chimiques pour former la matière organique du sol. (Schmidt et al. 2011 ; Kögel-Knabner et Amelung, 2013). Certains intrants demeureront dans le sol (sous forme de matière organique du sol ou sous l’effet d’interactions avec les minéraux argileux ; Oades, 1988 ; Kleber et al. 2007) tandis que d’autres seront évacués par érosion ou lessivage (Bailey et al. 2019).
L’origine de la matière organique dans le sol varie selon les propriétés de l’écosystème et les pratiques de gestion des terres, mais il s’agit principalement de nécromasse provenant des organismes du sol (de la macro à la microéchelle) et de la litière végétale aérienne (épigée) et souterraine (hypogée) (Schmidt et al. 2011 ; voir la figure 3.1). Certains sols peuvent également recevoir des intrants tels que des pesticides, des herbicides, des engrais et du biochar (charbon de bois) provenant de processus liés à la gestion des terres et à d’autres activités anthropiques. Les apports en végétaux constitueraient une source majeure de matière organique dans le sol (Kögel-Knabner, 2002), mais certaines études laissent croire que l’on sous-estimerait la contribution des microorganismes (Simpson et al. 2007). Les apports de matière organique dans le sol et leur nature dépendent de l’environnement du sol ainsi que de la gestion de l’écosystème. Il faut également considérer la composition de la matière organique du sol, qui se trouve étroitement liée au développement de ce dernier (voir le chap. 2). En effet, les jeunes sols peuvent ne pas contenir autant de matière organique que les vieux sols, qui eux ont eu le temps de développer un horizon O ou A épais, compte tenu du sol en cause et des caractéristiques environnantes. Par exemple, les horizons chernozémiques Ah sont riches en matière organique, en particulier les chernozems noirs que l’on retrouve dans les climats froids. Ces conditions froides favorisent l’accumulation de matière organique dans le sol. En revanche, les horizons Ap contiennent moins de carbone que leur homologue d’origine (Ah) en raison de l’agriculture. De plus, la matière organique s’accumule dans les tourbières en raison de la saturation en eau et des conditions anaérobies, ce qui a pour effet de limiter l’activité microbienne.
Les facteurs clés de formation du sol (en abrégé, clorpt) sont : le climat, les organismes (biote), le relief (topographie), les matériaux d’origine (matériau parental) et le temps (Jenny, 1941). Ces facteurs jouent également un rôle dans la formation de la matière organique et la biogéochimie du sol. La composition (qualité) et l’importance (quantité) des intrants (apports) de matière organique varient selon les écosystèmes. Également, le climat détermine les types de biote présents ainsi que leur activité. La topographie peut déterminer la disponibilité de l’oxygène nécessaire à la dégradation aérobie des intrants de matière organique ainsi que de celle déjà stockée dans le sol. Elle peut également influer sur la teneur en eau du sol, nécessaire à la croissance des plantes. La teneur en eau peut limiter la décomposition microbienne des apports végétaux et favoriser l’accumulation de matière organique, comme dans les zones humides. Les matériaux d’origine et la formation de minéraux secondaires jouent également un rôle important dans la nature de la matière organique présente dans le sol ; les minéraux argileux peuvent se lier avec elle, ce qui augmente la stabilisation de la matière organique au fil du temps.
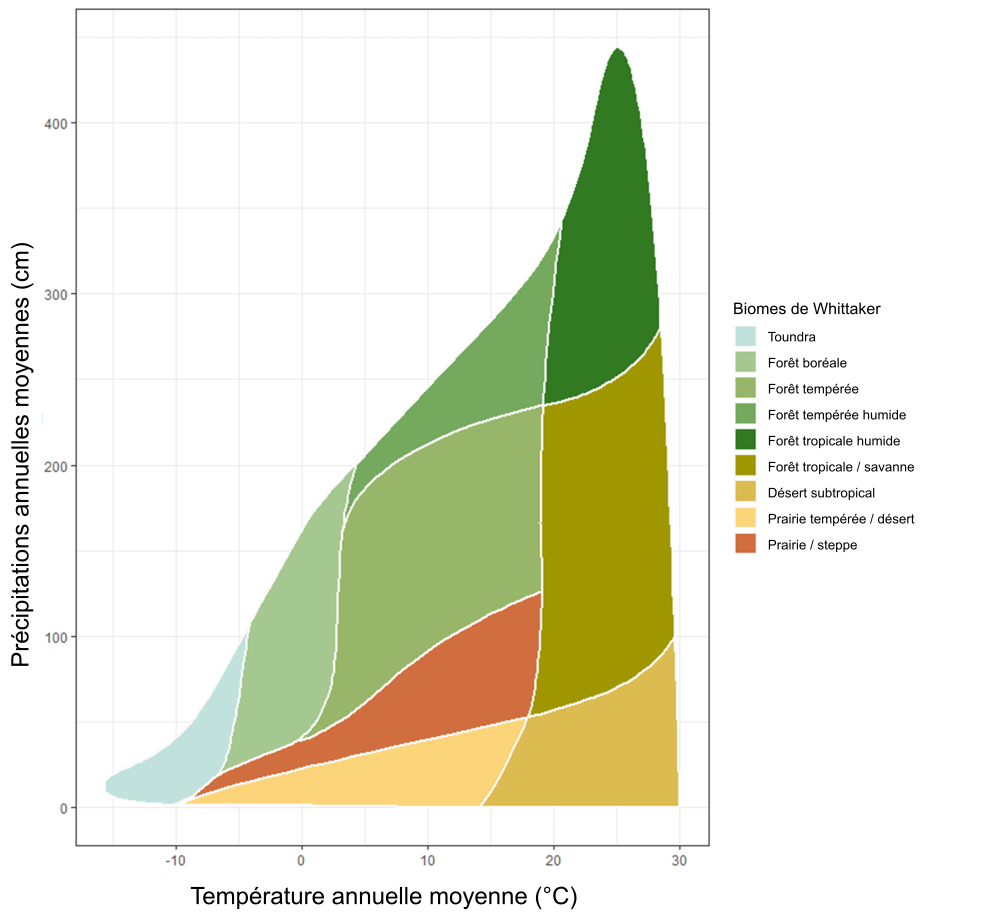
Les conditions climatiques telles que la température annuelle moyenne et les précipitations annuelles moyennes influencent aussi de façon importante les processus associés aux apports de matière organique au sol, à court et à long terme. Par exemple, la température et l’humidité seront des facteurs déterminants dans la composition floristique et structurelle d’un écosystème ; sur les territoires forestiers au climat frais, la présence des conifères supplantera celle des feuillus. Les types et la quantité d’arbustes et d’herbacés présents sont également déterminés par le climat de même que par d’autres propriétés du sol. La figure 3.2 montre les intervalles de températures et de précipitations annuelles moyennes de différents biomes. Ces facteurs contribuent également à la quantité et à la qualité des intrants dans le sol et dans quelle mesure ils sont transformés. Les climats plus chauds facilitent la dégradation de la matière organique du sol (par la respiration microbienne) et favorisent la croissance des plantes. Les climats frais peuvent limiter la croissance des plantes, mais peuvent également restreindre le phénomène de dégradation microbienne et de bioturbation par la macrofaune.
Tel que l’illustre la figure 3.1, différents types d’intrants (apports de matière organique) pénètrent dans le sol ; certains demeureront par mécanisme de sorption avec les minéraux argileux et certains seront dégradés par le biote natif du sol. Depuis plusieurs décennies, les études sur la chimie des apports de matière organique au sol portent autant sur les processus de formation de la matière organique du sol que sur ce qui lui confère sa stabilité. Le tableau 3.2 présente les principaux types de composés qui pénètrent dans le sol et la nature de leur provenance.
Tableau 3.2. Principaux composés organiques incorporés au sol et leurs propriétés qui contribuent à la formation et à la persistance de la matière organique dans le sol (Kögel-Knabner 2002 ; Schmidt et al. 2011 ; Kögel-Knabner et Amelung 2014)
| Composé | Origine | Taille de molécule | Stabilité |
|---|---|---|---|
| Lipidesa | Plantes et microorganismes | Petites molécules | Varie (faible-élevé) avec la longueur de la chaîne carbonée et le groupe fonctionnel |
| Protéinesb | Plantes et microorganismes | Macromolécules | Moyenne |
| Cellulose (hémicellulose) | Plantes et microorganismes | Macromolécule | Faible |
| Lignine | Plantes | Macromolécule | Moyenne à élevée |
| Chitine | Champignons et arthropodes | Macromolécule | Moyenne à élevée |
| Cutine | Plantes (cuticule : revêtement cireux sur les feuilles) | Macromolécule | Élevée |
| Subérine | Racines | Macromolécule | Faible à élevée |
| Charbon/biochar | Matériel végétal pyrolysé | Macromolécule | Élevée |
| aLes lipides représentent une large gamme de composés qui ont des longueurs de chaîne de carbone caractéristiques et des fonctionnalités diverses. Certains composés de cette nature ont des groupes alcool ou acide. | |||
| bEnglobe un grand groupe de molécules aux propriétés chimiques et états de stabilité divers. | |||
Dégradation des apports de carbone
La composition chimique des apports de matière organique au sol (tableau 3.2) constitue un facteur clé de leur susceptibilité à la dégradation microbienne une fois qu’ils se retrouvent dans l’environnement du sol. Certains composés se dégradent plus rapidement que d’autres. La plupart des composés sont de grosses molécules (macromolécules) qui se décomposent par étapes. Par exemple, la cellulose est un glucide complexe, mais une fois sa structure macromoléculaire décomposée, elle produit des sucres simples qui peuvent être facilement dégradés. La lignine, qui est une autre macromolécule constituée d’un réseau de composés aromatiques (phénoliques), est plus difficile à décomposer ; ce sont principalement les champignons qui la décomposent. Par conséquent, la décomposition des apports végétaux est fonction de leur composition chimique, de la présence des microorganismes et des enzymes, ainsi que de la teneur en éléments nutritifs et de bien d’autres facteurs environnementaux (tels que l’oxygène et l’eau).
Dans des conditions aérobies, les apports de matière organique se trouvent dégradés par la respiration (équation 1.3). La respiration, également appelée minéralisation, est une réaction d’oxydation où l’oxygène agit comme principal accepteur d’électrons (Bohn et al. 1985). Les produits finaux de cette réaction (équation 1.3) sont le dioxyde de carbone et l’eau. Comme il est indiqué ci-dessous, l’apport de matière organique (CH2O) produit quatre électrons (équation 1.1), qui nécessitent ensuite la quantité équivalente d’oxygène (équation 1.2) pour équilibrer la réaction (équation 1.3) :
CH2O + H2O → CO2 + 4e– + 4H+ (1.1)
O2 + 4e– + 4H+ → 2H2O (1.2)
CH2O + O2 → CO2 + H2O (1.3)
Il faut davantage d’énergie chimique pour dégrader des formes complexes de matière organique (Bohn et al. 1985). Par exemple, si l’on considère des formules empiriques à la fois pour la lignine (C2.9H2.9O) et la cellulose (C1.2H2O), il est évident que la dégradation du matériel végétal (estimée à deux tiers de cellulose et à un tiers de lignine aux fins de cet exemple ; équation 2.1) nécessitera moins d’énergie chimique et moins d’oxygène (qui agit comme accepteur d’électrons terminal) que la matière organique du sol (représentée empiriquement par C2.2H2.2O ; équation 2.2). C’est l’une des raisons pour lesquelles les formes complexes de matière organique présentent une meilleure stabilité par rapport à d’autres formes en plus de persister plus longtemps qu’elles dans le sol (tableau 3.1).
Plant matter decomposition: C1.7H2.2O → 1.7C4+ + H2O + 7e– + 0.2H+ (2.1)
Soil organic matter: C2.2H2.2O → 2.2C4+ + H2O + 9e– + 0.2H+ (2.2)
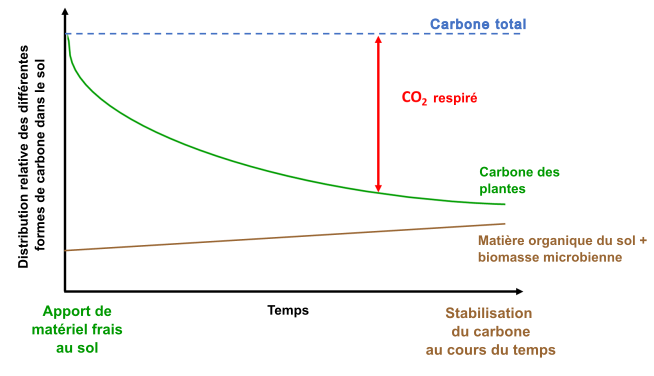
Les apports des plantes et des microorganismes sont décomposés en CO2 par oxydation, comme l’indique l’équation 1.3. Cependant, la vitesse à laquelle la respiration se produit dépend des propriétés de l’écosystème, de la biomasse, de microorganismes et de sa diversité et de la disponibilité des éléments nutritifs. La figure 3.3 montre le devenir de matériel végétal frais dans le cycle du carbone du sol. L’ajout de résidus de plantes fraîches au sol stimule souvent l’activité microbienne (phénomène appelé « amorçage du sol » ; Kuzyakov et al. 2000). Or, cet ajout peut entraîner la dégradation en continu du carbone stocké dans le sol selon les réactions décrites aux équations 2.1 et 2.2 jusqu’à en réduire les réserves. Dans certains cas, la décomposition de la matière végétale fraîche peut également augmenter le carbone stocké dans le sol (rappelez-vous, le carbone du sol comprend à la fois du vivant et du non vivant). En conséquence, l’ajout de plantes fraîches peut altérer la dynamique du carbone du sol mais de manière différente selon la nature des intrants, la présence de décomposeurs microbiens et d’enzymes, la teneur en oxygène, en eau et le temps. Dans l’exemple présenté à la figure 3.3, le carbone végétal frais est en partie décomposé en CO2 par la respiration et également stocké dans le sol sous forme de carbone du sol. La quantité totale de carbone ne change pas (le bilan carbone se maintient), mais la nature des différents réservoirs de carbone (CO2 atmosphérique, matière organique du sol, microorganismes du sol, etc.) varie avec le temps, l’espace et les propriétés de l’écosystème. Par exemple, le rythme de conversion de la matière organique en carbone végétal sera plus rapide dans les sols aérobies des régions chaudes du monde que dans ceux des régions froides. Dans les écosystèmes des régions froides, la conversion du carbone végétal en d’autres formes de carbone peut prendre de nombreuses décennies. Par ailleurs, dans les conditions anaérobies, le processus de respiration (conversion du carbone végétal en CO2) est beaucoup plus lent en raison du manque de la disponibilité d’O2 (voir équation 2.1). Dès lors, l’échelle de temps nécessaire à la conversion du carbone végétal en d’autres formes varie en fonction de la nature du composé végétal, du climat de même qu’en fonction de certaines propriétés de l’écosystème.
Matière à réflexion !
Substances humiques
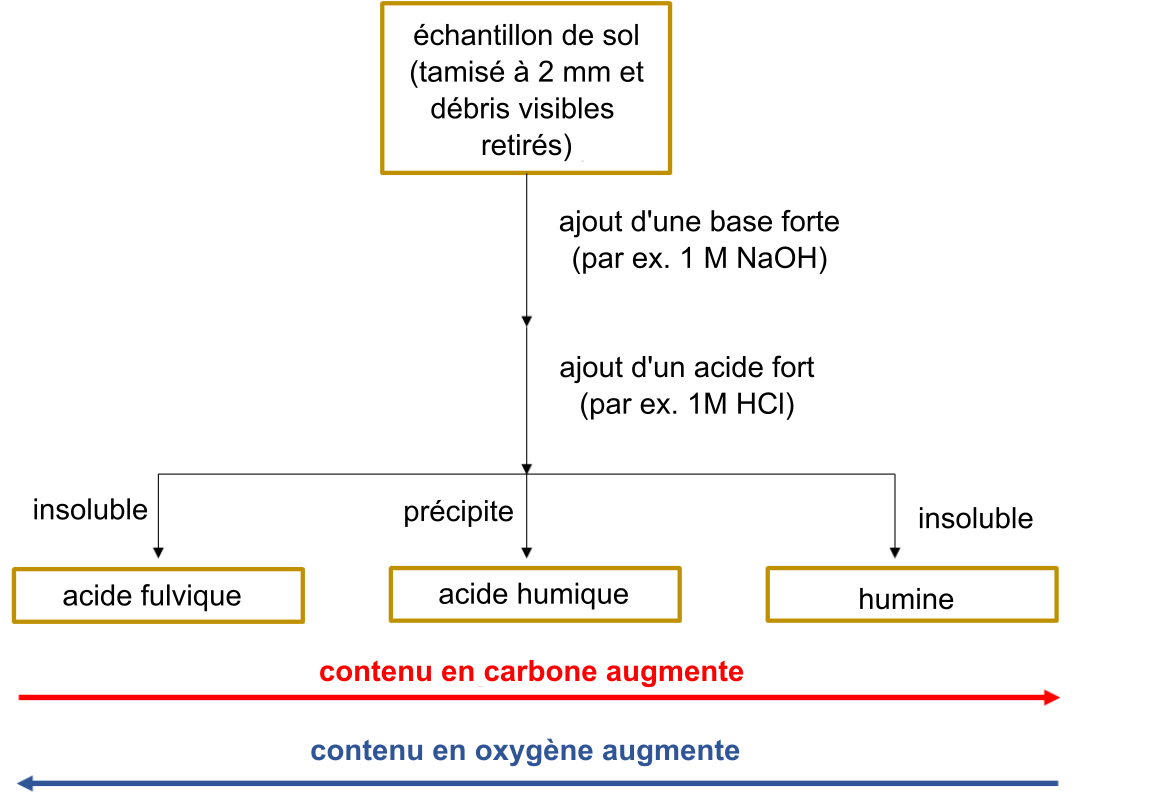
On a longtemps pensé que la stabilité à long terme de la matière organique du sol était attribuable à la conversion des intrants végétaux et animaux en substances humiques suivant différentes réactions biologiques et chimiques. La méthode de fractionnement traditionnelle qui permet d’isoler les différentes fractions de la matière organique du sol (Schmidt et al. 2011 ; Lehmann et Kleber 2015) consiste à utiliser une série de bases et d’acides forts qui sépare la matière organique du sol en fonction de sa solubilité (voir la figure A). Une partie de la matière organique du sol n’est extractible ni dans une base forte ni dans un acide fort. La caractérisation des fractions résultantes a permis d’en savoir plus sur la composition de la matière organique (voir la figure B).
Traditionnellement, ces fractions de substances humiques (acide fulvique, acide humique et humine) étaient analysées par analyse élémentaire et d’autres méthodes d’analyse chimique à faible résolution. Les résultats des analyses ont révélé des fractions de poids moléculaire élevé (macromolécules). On pensait alors que ces macromolécules — considérées comme stables — devaient constituer le seul apport au sol qui ne subissait aucune transformation dans les environnements pédologiques.
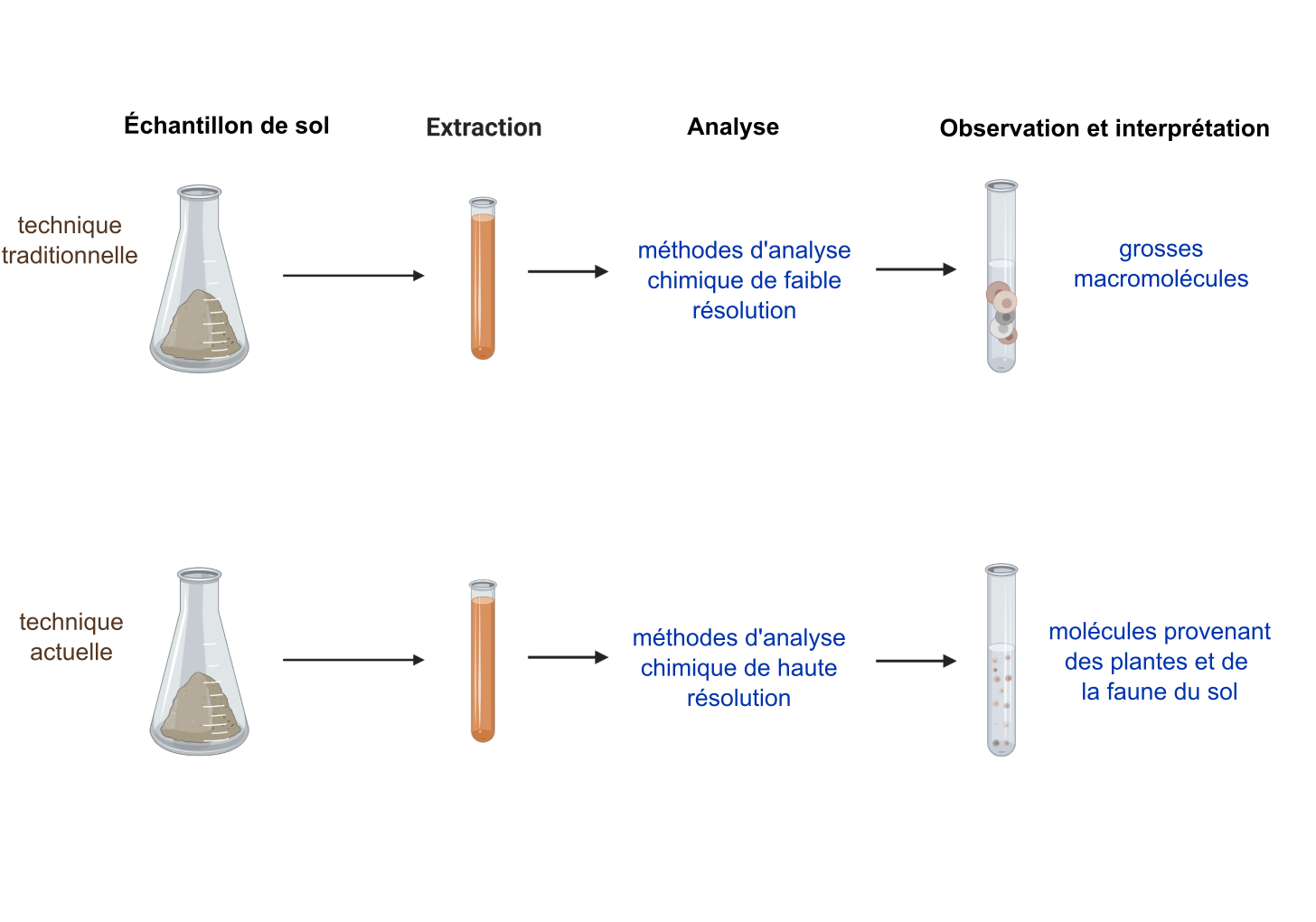
Les avancées technologiques de la fin des années 1990 en matière de méthodes d’analyse chimique ont permis aux scientifiques d’obtenir des données à haute résolution sur la chimie de la matière organique du sol (Kelleher et Simpson 2006 ; Schmidt et al. 2011). Ces méthodes ont montré que la matière organique du sol était en fait constituée de biomolécules reconnaissables provenant de plantes et d’animaux observables dans divers stades de dégradation (voir la figure B). Ces méthodes ont également montré que ces biomolécules pouvaient s’associer les unes aux autres et se comporter comme de grosses molécules (conformément au point de vue traditionnel). Les scientifiques recourent désormais à ces nouvelles informations pour tenter d’expliquer comment la matière organique se stabilise dans différents environnements de sol dans le contexte des changements climatiques.
Persistance de la matière organique du sol
De nombreux intrants organiques qui entrent dans le sol sont transformés en matière organique du sol ou sont minéralisés en CO2. Cependant, une partie de la matière organique du sol peut y demeurer des décennies, voire des siècles. Une partie de cette matière organique persistante est attribuable à la forte interaction qui existe entre la matière organique du sol et les minéraux argileux (Oades 1988 ; Schmidt et al. 2011 ; Simpson et Simpson 2012 ; voir figure 3.4). Les minéraux argileux contribuent à stabiliser la matière organique du sol en formant avec elle des complexes organominéraux (figure 3.4 b). Les minéraux argileux amorphes et cristallins peuvent lier la matière organique du sol, mais à des degrés divers et suivant différentes interactions chimiques telles que les interactions covalentes, ioniques ou faibles de van der Waals (Feng et al. 2005 ; Kleber et al. 2007). Bien que la manière dont la matière organique du sol interagit avec les minéraux argileux diffère dans chaque environnement de sol, il est clair que le fait qu’elle puisse former des liaisons avec les minéraux argileux augmente sa persistance (Baldock et Skjemstad 2000). Une fois séquestrée sur une surface argileuse, la matière organique devient moins accessible aux microorganismes. C’est pourquoi la matière organique du sol liée aux minéraux argileux persiste plus longtemps, car les microorganismes ne peuvent l’utiliser facilement comme substrat. D’autres surfaces minérales telles que les les oxydes de fer et d’aluminium, permettent à la matière organique de persister dans les sols acides. Dans les sols neutres et alcalins, la présence de cations polyvalents, tels que le calcium et le magnésium, stabilise la matière organique en formant des ponts entre les molécules organiques chargées négativement et les surfaces argileuses. Le type de minéraux argileux est également déterminant dans la quantité de carbone qui peut être stockée dans un sol. Les minéraux argileux avec des surfaces élevées (argiles 2:1) ont une plus grande capacité à adsorber le carbone que les argiles 1:1. Au Canada, où les sols sont encore relativement jeunes, la minéralogie des argiles reflète principalement celle du matériau géologique d’origine.
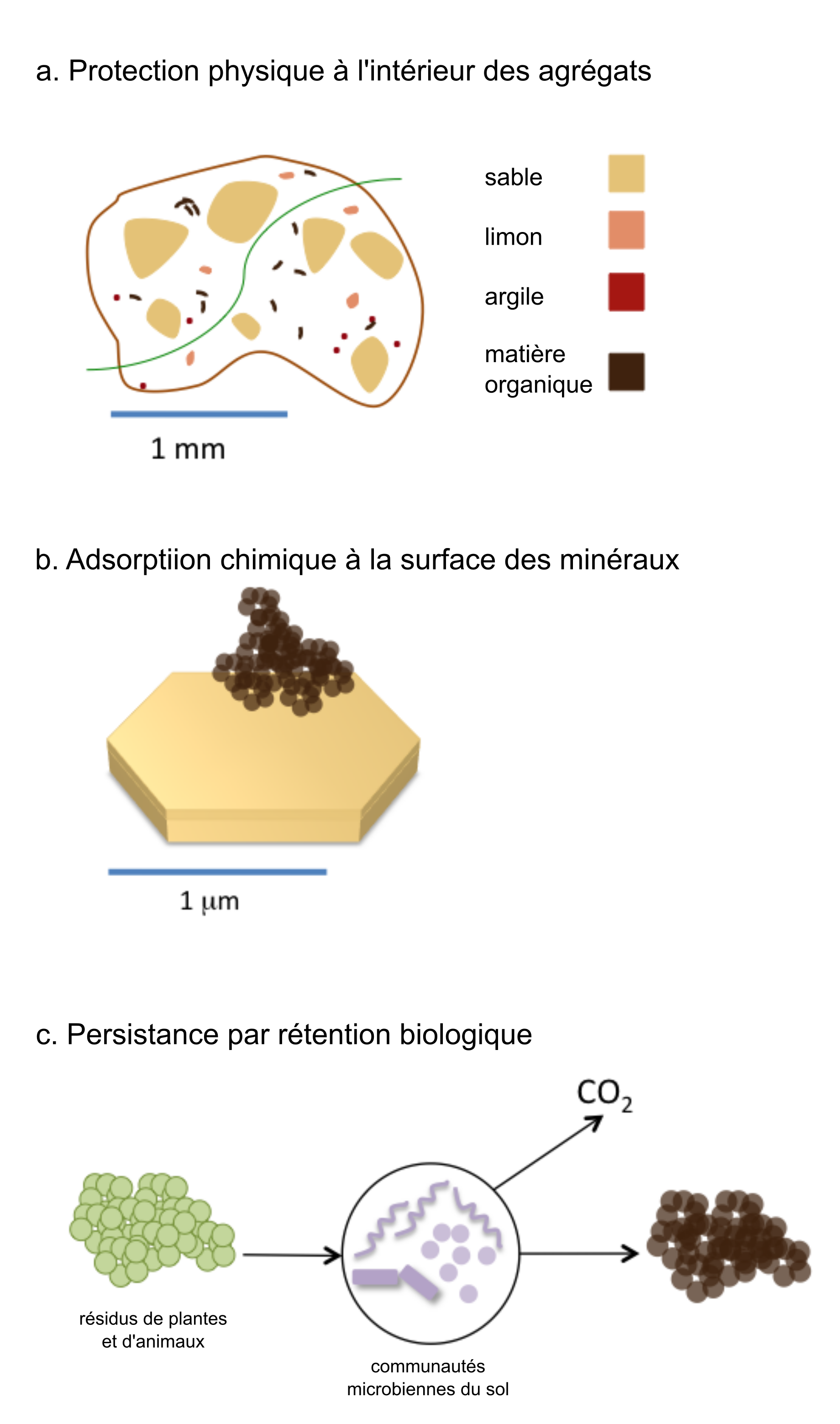
En plus de l’interaction qui lie la matière organique et les surfaces minérales, la protection physique de la matière organique à l’intérieur des agrégats (figure 3.4a) est considérée comme un mécanisme important de sa persistance dans le sol (Six et al. 2002). Dans ce cas, la matière organique persiste principalement parce qu’elle est spatialement séparée des communautés de microorganismes décomposeurs. De plus, la plus faible disponibilité en oxygène dans les agrégats peut devenir un autre facteur limitatif de l’activité des microorganismes. Dans les écosystèmes boréaux, qui couvrent la majorité de la superficie du Canada, le feu est une perturbation récurrente qui produit du carbone pyrogène, souvent appelé carbone noir ou charbon. Le carbone pyrogène, qui contient des structures aromatiques très condensées, peut persister dans le sol et constituer un puits de carbone à long terme (Ohlson et al. 2009). Cependant, la persistance du carbone pyrogène dans le sol varie fortement en fonction de ses conditions de formation (Soucemarianadin et al. 2015).
Traditionnellement, les pédologues ont toujours souligné l’importance de considérer la structure chimique de la matière organique pour expliquer sa persistance dans le sol. Cependant, un nouveau paradigme défend désormais plutôt l’idée que la structure moléculaire ne peut à elle seule servir d’explication à la persistance de la matière organique dans le sol, car elle n’explique pas le phénomène d’accumulation et de stabilisation. Par ailleurs, le métabolisme des microorganismes, et plus particulièrement leur capacité à utiliser efficacement le carbone, joue un rôle dans la détermination de la persistance de la matière organique dans le sol (Cotrufo et al. 2013). Selon ce nouveau paradigme (figure 3.4c), les molécules les plus labiles constituent la majeure partie de la matière organique stable du sol, car elles sont préférentiellement assimilées par les microorganismes, donc retenues dans le sol.
COMMENT GÉRER LA MATIÈRE ORGANIQUE DU SOL ?
Facteurs environnementaux
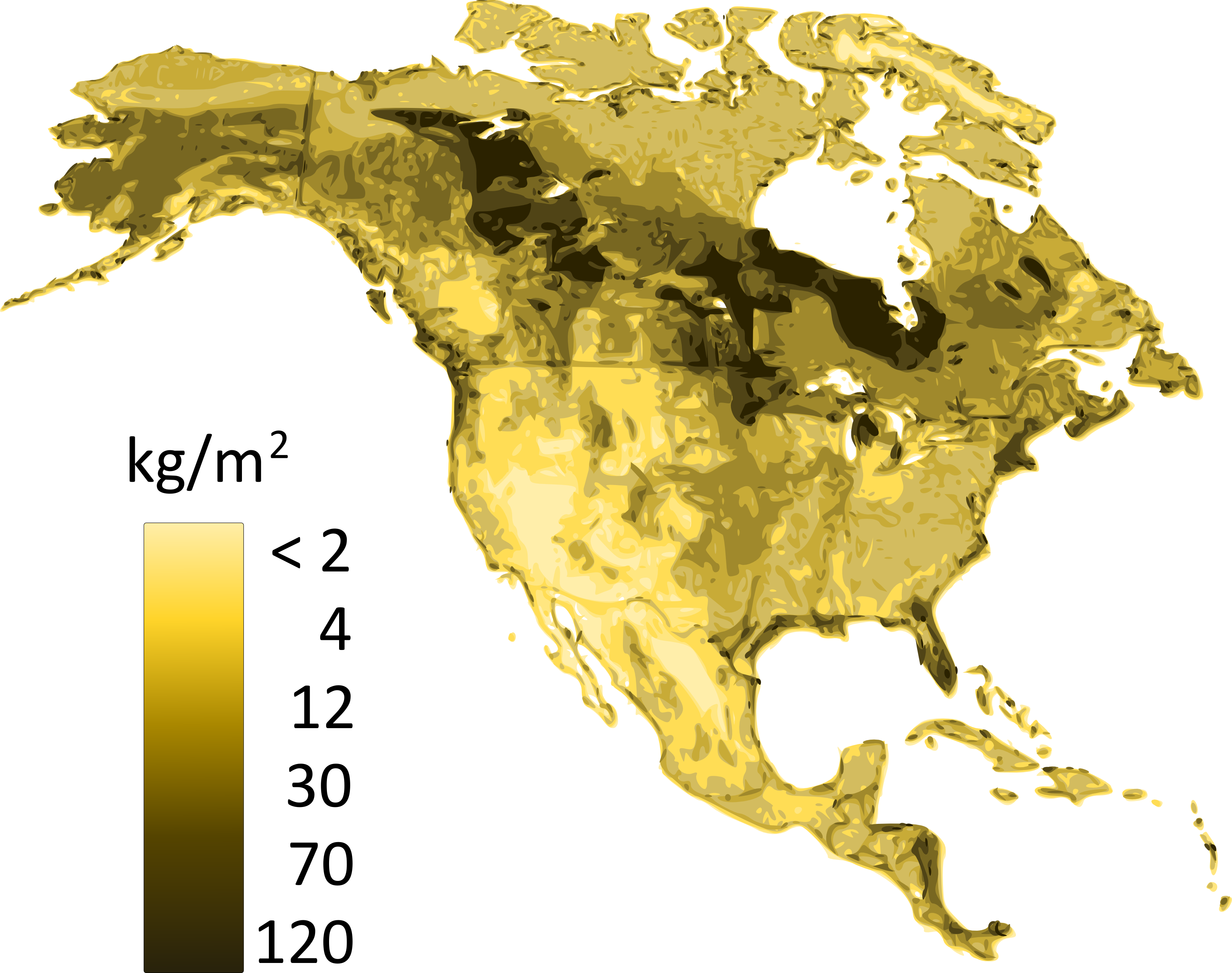
Le stockage du carbone dans le sol résulte de l’équilibre entre les entrées (apports ou intrants) et les sorties (pertes) de carbone. La séquestration du carbone se produit lorsque les apports de surface et souterrains (c.-à-d. feuilles et racines) dans le sol dépassent les pertes, constituées principalement d’émissions de CO2, mais aussi de méthane (CH4), et de carbone organique dissous (COD) dans les eaux de drainage. Les résidus végétaux constituent la matière de base pour la formation de la matière organique du sol. Lorsque les communautés de microorganismes décomposent la litière végétale, la majorité du carbone contenu dans ces résidus se transforme éventuellement en CO2. Cependant, une petite partie de matière organique demeure dans le sol, parfois pendant des siècles sinon des millénaires. La figure 3.5 montre la répartition du carbone (lié à la matière organique) dans les sols d’Amérique du Nord et en particulier ceux du Canada. L’état d’équilibre complexe des entrées et sorties, ainsi que la stabilisation de la matière organique par les minéraux argileux, sont les principaux facteurs qui déterminent le caractère de persistance de la matière organique dans le sol.
Le taux d’accumulation du carbone dans le sol varie considérablement d’un sol à l’autre, ce qui reflète l’influence des facteurs environnementaux (c.-à-d. les facteurs de formation du sol : climat, organismes, matériau géologique d’origine, relief et temps) sur les processus pédogénétiques. Le climat affecte directement les stocks de carbone du sol en assurant l’équilibre entre les apports de litière et les produits de décomposition. L’augmentation des précipitations fait augmenter la croissance des plantes et la production de litière, tandis que la diminution de la température fait diminuer les pertes par décomposition. À l’échelle mondiale, l’accumulation de carbone dans les sols est plus influencée par la température que par les précipitations ; le carbone tend à s’accumuler dans les sols des hautes latitudes où les basses températures limitent la décomposition. Les stocks de carbone les plus importants se trouvent dans la région du pergélisol au nord où il y a à la fois des sols organiques et des cryosols. Dans les environnements arides, l’insuffisance d’eau peut limiter la croissance des plantes et la quantité de résidus végétaux apportée aux sols faisant alors diminuer les réserves de carbone du sol.
Partout sur le territoire canadien, les réserves de carbone du sol varient également en fonction des quantités de précipitations ; où elles sont élevées, principalement le long des côtes de l’Atlantique et du Pacifique, ce qui facilite d’établissement d’une végétation forestière dense et conséquemment, à des apports importants en litière à la surface du sol. De plus, la position des apports de végétation dans le sol influence directement la distribution du carbone dans le profil du sol ainsi que les stocks totaux de carbone. Les sols de prairies renferment beaucoup de racines ; or, cet apport souterrain de matière organique bien distribué dans tout le profil du sol contribue à la constitution d’importants stocks de carbone. Dans les sols forestiers, les stocks de carbone peuvent diminuer abruptement le long du profil. Enfin, si la végétation peut se révéler le facteur principal d’accumulation de carbone organique dans le haut d’un profil de sol, la géologie du matériau d’origine du sol peut également être un facteur clé de séquestration du carbone dans le sol minéral.
Les teneurs en carbone et en argile du sol sont positivement corrélées à la fois par le fait que les complexes organominéraux offrent une grande résistance à la décomposition — réduisant du coup les pertes — et par le fait que les propriétés fertilisantes de l’argile, en favorisant la croissance des plantes, font augmenter les retours de carbone dans le sol.
À l’échelle du paysage, le bas des pentes est la position topographique de choix pour l’accumulation de carbone organique. En effet, les conditions d’humidité plus élevées à cet endroit se trouvent à limiter la décomposition, causant conséquemment moins de pertes. De même, l’orientation nord des versants des paysages de l’hémisphère Nord jouera en faveur de l’accumulation de carbone dans le sol par rapport à l’orientation sud de ces mêmes paysages, car la température moins propice à l’évaporation fait augmenter l’humidité du sol résultant en moins de décomposition.
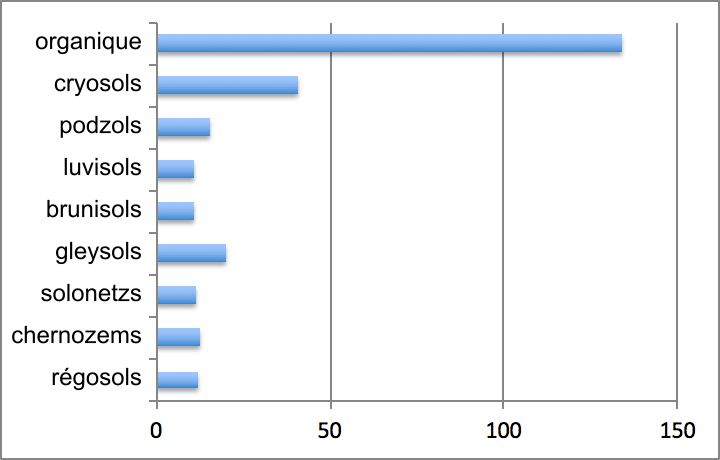
Les réserves moyennes de carbone dans les divers ordres de sols minéraux trouvés au Canada varient d’environ 11-12 g m-2 dans les régosols, brunisols, luvisols, chernozems et solonetz à 16-20 g m-2 dans les podzols et gleysols. Dans les sols forestiers, les stocks de carbone augmentent des sols luvisoliques et brunisoliques bien drainés aux sols gleysoliques et organiques mal drainés (figure 3.6). Les stocks de carbone dans les sols organiques peuvent être d’un ordre de grandeur plus élevé que les stocks dans d’autres types de sols, soit de l’ordre moyen de 134 g m-2. Parmi les ordres de sols minéraux, ce sont les cryosols qui contiennent les stocks les plus élevés avec une moyenne de 41 g m-2. Les cryosols occupent également la plus grande superficie au Canada pour constituer en superficie plus du tiers des sols canadiens. Les cryosols et les sols organiques contiennent à peu près la même quantité de carbone ; à eux deux, ils constituent de loin le réservoir de carbone canadien le plus important par rapport aux autres ordres de sols. Ensemble, ces deux ordres de sols représentent environ 80 % des réserves totales de carbone contenues dans les sols canadiens. Les podzols et les brunisols en représentent 5 à 10 %, et les ordres de sol restants, moins de 5 %.
Les processus pédogénétiques (c.-à-d. les processus de formation d’un sol) peuvent affecter directement les stocks de carbone présents dans un sol, de même que leur stabilité. La teneur en carbone du sol est l’un des critères de différenciation clé de la classification des sols. L’exemple qui vient spontanément à l’esprit est celui des sols qui entrent dans la grande subdivision des sols dits organiques ; les subdivisions sont établies en fonction de l’épaisseur de matière organique observée chez chacun d’eux, car elle documente leur formation respective. La paludification, qui définit le phénomène d’accumulation d’une épaisse couche organique à la surface du sol minéral, crée les horizons fibrique (Of), mésique (Om) et humique (Oh) caractéristiques des sols organiques. À la surface d’un sol forestier bien drainé, on peut distinguer trois couches de matière organique suivant leur degré de décomposition : la litière (L), où les formes originelles de la matière organique sont facilement reconnaissables ; la couche fibrique (F), où la matière organique accumulée est partiellement décomposée, et la couche humique (H), où les formes originelles de la matière organique ne sont plus visibles (voir le chap. 8 pour en savoir plus).
L’humification, soit la formation de substances humiques à partir de résidus végétaux, et la mélanisation, soit l’assombrissement de la couleur du sol attribuable à l’ajout de carbone, sont deux causes de l’accumulation de carbone au sein des couches supérieures du sol minéral, en particulier dans les horizons chernozémiques. La formation de ces horizons est favorisée par le vaste réseau de racines des graminées, sources des nombreux apports d’exsudats et de résidus. La bioturbation par les vers de terre et la stabilisation de la matière organique par le calcium sont deux processus courants qui contribuent à l’accumulation de carbone dans les chernozems canadiens. L’intensité de l’assombrissement est un critère de différenciation des grands groupes chernozems et solonetzs auquel on ajoute un sous-critère de quantité croissante de carbone, ce qui donne les grands groupes brun, brun foncé et noir. L’absence ou la présence d’un horizon Ah riche en carbone sert de critère de différenciation des grands groupes de brunisols, luvisols, gleysols et régosols ; c’est-à-dire les brunisols mélaniques et sombriques, les luvisols bruns gris, les gleysols humiques et les régosols humiques. Enfin, la teneur en carbone sert également de critère de différenciation en sous-groupes de nombreux autres ordres de sols minéraux. Pour sa part, le processus de podzolisation entraîne une accumulation de carbone en profondeur dans le profil de sol contrairement aux processus que l’on vient de mentionner. En cours de processus de podzolisation, il y a ajout de carbone qui provient des matières organiques solubles lessivées depuis la surface du sol. L’autre apport de carbone entraîné à la verticale dans le profil de sol proviendrait des exsudats racinaires ou du renouvellement racinaire. Les grands groupes podzoliques se différencient partiellement selon leur teneur en carbone, les podzols ferro-humiques contenant plus de carbone en profondeur que les podzols humo-ferriques.
Enfin, certains processus qui ne sont pas directement liés à l’humification peuvent néanmoins contribuer à faire augmenter le carbone du sol. La gleyification, qui entraîne des conditions anaérobies, peut conduire à l’accumulation de carbone dans les gleysols. Le froid extrême, qui freine également la décomposition, peut entraîner une forte accumulation de carbone de surface chez les cryosols organiques et, dans le cas des cryosols turbiques, une accumulation de carbone dans les horizons minéraux, qui peut également se produire en profondeur en raison de la cryoturbation, processus de mélange du sol attribuable au gel et au dégel.
Aménagement du territoire
Au Canada, la conversion des terres d’origine en terres arables a entraîné une perte d’environ 25 % du carbone qui était présent dans les couches superficielles du sol (0-30 cm) avant le début de la l’agriculture. En d’autres termes, la perte de carbone au cours du 19e siècle dans les sols des prairies cultivées au Canada aurait entraîné l’émission d’environ 1 Pg (Janzen et al. 2018).
Les pertes de carbone peuvent être attribuées à l’élimination des résidus de récolte ainsi qu’à l’augmentation de l’érosion et de la décomposition. Dans certains cas, l’utilisation du feu comme moyen de défrichement des terres a fait augmenter les pertes. L’augmentation de la décomposition, plutôt que l’érosion, est généralement le principal facteur de perte de carbone après la culture. Cette augmentation vient de la perturbation physique des agrégats du sol causée par le travail du sol, qui a pour effet de rendre accessible la matière organique — auparavant inaccessible — aux microorganismes du sol qui se chargent de la décomposer. La majeure partie du carbone perdu en raison de l’agriculture est constituée de la fraction organique légère du sol, celle composée de résidus végétaux encore « jeunes », qui ne sont que partiellement décomposés. La plupart des pertes se produisent rapidement, c.-à-d. au cours des 20 premières années qui suivent la conversion des sols d’origine en sols agricoles de labour.
En raison des pertes de carbone que les sols agricoles ont subies avec le temps, leur capacité d’en stocker est remarquable. Plusieurs pratiques peuvent favoriser l’accumulation de carbone dans le sol. Certaines peuvent réduire les pertes de carbone du sol, notamment le fait de peu travailler le sol et de réduire les jachères d’été. Certaines mesures contribuent à l’augmentation du carbone dans un sol : ajouter d’autres sources de carbone (p. ex., fumier, biochar) ; favoriser la part des plantes dans leur rôle d’apport de carbone dans le sol soit par 1) la pratique des cultures de couverture, 2) l’amélioration de la rétention des résidus, 3) l’amélioration de l’utilisation des plantes vivaces et 4) l’optimisation de la fertilisation. Parce qu’elle favorise la croissance des plantes, la fertilisation chimique (c.-à-d. l’ajout d’engrais minéraux) entraîne généralement une accumulation de carbone dans le sol. Le taux de stockage annuel de carbone dans un sol qui a été fertilisé avec des engrais minéraux a été estimé à 23 ± 13 g C m-2 an-1 (VandenBygaart et al., 2004). L’application d’amendements organiques tels que le fumier animal ou les biosolides (déchets humains) fait également augmenter le carbone du sol, surtout si on les applique d’une manière régulière pendant de nombreuses années, voire des décennies. Cependant, cette pratique peut également contribuer à faire augmenter la production de gaz à effet de serre, en particulier le protoxyde d’azote. La limite supérieure de séquestration du carbone du sol peut être atteinte dès que la matrice du sol devient saturée en carbone. Elle a alors atteint sa pleine capacité de stockage. Les sols à texture fine ont une plus grande capacité à stocker le carbone que les sols à texture plus grossière.
Les pratiques de conservation des sols, y compris le travail du sol réduit et le « sans travail » du sol, peuvent favoriser l’accumulation de carbone, bien que des études récentes aient montré (1) que cette augmentation ne concernerait que la couche supérieure du sol (0-10 cm) et (2) que le travail du sol n’ait aucun effet sur les stocks de carbone s’ils s’intègrent dans toute la profondeur du sol (0-130 cm) (Mary et al. 2020).
Plusieurs activités anthropiques ont le potentiel d’influencer la matière organique du sol. La conversion des terres d’origine à des fins agricoles peut réduire la teneur en matière organique du sol, en particulier s’il y a travail du sol. Le phénomène a été bien documenté. On tente de préserver la matière organique dans les terres agricoles par l’incorporation de résidus de récolte dans le sol et par l’adoption de pratiques de conservation du sol. On applique les résidus de culture en surface après la récolte, qui se réincorporent dans le réservoir de matière organique du sol. L’application de résidus carbonisés (biochar ou par culture sur brûlis) améliore à la fois la teneur en matière organique du sol et sa capacité d’échange cationique. En plus, cela a pour effet de modifier le pH du sol, ce qui profite à la fois aux plantes et aux microorganismes du sol. Le biochar peut persister longtemps dans le sol. Bien que sa composition et ses bénéfices changent avec le temps, son ajout contribue tout de même au maintien d’un continuum global de matière organique dans le sol.
Alors que le déboisement (aussi nommé déforestation) entraîne généralement une perte de carbone du sol, le reboisement peut, du moins en partie, restaurer les teneurs en carbone du sol d’origine. Le reboisement effectué dans la zone boréale entraîne un taux d’augmentation du carbone du sol plus faible par rapport à du reboisement effectué sous d’autres climats, probablement parce que le taux de croissance des arbres y est plus lent (Laganière et al. 2010). Le type de perturbation qui a mené au déboisement et l’utilisation des terres antérieures au reboisement vont aussi influencer le taux d’augmentation du carbone du sol à la suite du reboisement. Par ailleurs, le reboisement des terres agricoles donne lieu à une augmentation plus importante des stocks de carbone du sol par rapport aux stocks résultant du reboisement des pâturages ou des prairies (Mayer et al. 2020). Le reboisement d’un sol perturbé par d’autres activités, telle que l’exploitation minière à ciel ouvert, peut également entraîner une augmentation des teneurs en carbone du sol (Prescott et al. 2019). Si elles sont adaptées aux conditions du site, les essences feuillues contribuent à faire augmenter les stocks de carbone du sol plus rapidement que les conifères ; à long terme, les feuillus contribuent également à l’atteinte de stocks de carbone plus élevés dans le sol minéral que dans la couverture morte.
Tableau 3.3. Effets des changements d’affectation des terres sur les stocks de carbone organique du sol. Compilé à partir de VandenBygaart et al. (2004), Horwath et Kuzyakov (2018) et Janzen et al. (2018).
| Pratiques de gestion | Lieu | Taux de stockage du carbone | Δ carbone du sol |
|---|---|---|---|
| (g C m-2 an-1) | (%) | ||
| Conversion des prairies pour l’agriculture | Est du Canada | -30 to -36 | |
| Conversion des prairies pour l’agriculture | Ouest du Canada | -11 to -59 | |
| Conversion des forêts pour l’agriculture | Est du Canada | -4 to –49 | |
| Conversion des forêts pour l’agriculture | Ouest du Canada | -11 to –36 | |
| Conversion globale à l’agriculture | Canada | -24 ± 6 | |
| Amendements organiques | Monde | + 40 to 62 | |
| Engrais chimiques | Canada | + 23 ± 13 | |
| Engrais chimiques | Monde | + 16 to 32 | |
| Engrais chimiques + amendements organiques | Monde | + 33 to 52 | |
| Travail conventionnel du sol à travail minimal du sol | Canada | + 5 to 16 | |
| Cultures de couverture | Monde | + 15 to 23 | |
| Reboisement des sols agricoles | Monde | + 9 to 51 |
COMMENT ÉVALUE-T-ON LA MATIÈRE ORGANIQUE DU SOL ?
Il existe deux grandes catégories d’analyse de la matière organique du sol : (1) l’analyse élémentaire totale et (2) la spéciation chimique. Les deux catégories d’analyses sont importantes car elles viennent répondre à tout un éventail de questions environnementales et agronomiques. Il est important de se rappeler que l’on fait une distinction entre matière organique du sol et carbone organique du sol, distinction qui se traduit dans la façon différente de les analyser. Il s’agit d’une distinction importante, car le caractère chimique de l’une et de l’autre livre de l’information tout aussi distincte et tout aussi importante. Le caractère chimique de la matière organique du sol en dit long sur sa persistance dans l’environnement, sur son comportement et sa dynamique de renouvellement. D’ailleurs, la teneur en matière organique du sol est une donnée qui fait universellement partie des analyses de base effectuées sur un sol. De nos jours, on peut même recourir à des analyses de fractions de matière organique du sol à cycle rapide, qui permettent de suivre l’évolution des pratiques de gestion. Ces analyses sont effectuées par de nouveaux progiciels d’analyses sur la santé des sols. Le recours à ces progiciels permet d’obtenir des données homogènes. Ce qui n’est pas le cas avec les nombreuses approches et techniques différentes encore utilisées à l’échelle opérationnelle, qui ne produisent pas nécessairement des mesures équivalentes. Cette section du chapitre présente et compare les méthodes courantes de mesure du carbone organique et de la matière organique du sol. Suivront quelques considérations sur le choix d’une méthode plutôt qu’une autre et sur l’interprétation de leurs résultats respectifs.
Tableau 3.4. Méthodes courantes de mesure du carbone du sol
| Méthode | Measure | Détails | Avantages | Désavantages |
|---|---|---|---|---|
| Combustion sèche | Carbone | Échantillon brûlé en O2 | Mesure directe du C du sol ; peut être automatisé ; peut également mesurer N | La présence des carbonates dans les sols calcaires vient brouiller les résultats sur la mesure du carbone. |
| Le CO2 dégagé est mesuré directement, généralementy >1000ºC | ||||
| Perte au feu (PAF) | Matière organique | Échantillon brûlé en O2 | Appareillage simple | Pas de discrimination du C des autres composés de la matière organique |
| Mesure la perte de masse | Analyse en vrac | L’eau de structure contribue à la perte de masse | ||
| Habituellement ~500ºC | ||||
| Oxydation humide | Matière organique | Oxydée chimiquement avec du chromate (Na2Cr2O7) | Cible uniquement la matière organique | Le chromate est cancérigène |
| Titrage par retour avec Fe (II) ou mesuré par spectroscopie | Le carbonate ne réagit pas | La réaction est incomplète | ||
| Le chromate réagit avec d’autres composantes du sol |
Combustion sèche
La combustion sèche est une technique courante que l’on utilise pour déterminer simultanément le carbone total et l’azote total. Des échantillons de sol séchés à l’air et pulvérisés (généralement < 250 µm de diamètre) sont placés dans un four à combustion à environ 1250 °C. Les échantillons sont brûlés dans un flux d’O2, qui produit du CO2 et des gaz d’oxyde d’azote (c.-à-d. NOx). Le flux d’O2 sert à assurer l’oxydation de tout le C et le N. Après la combustion, les gaz se trouvent évacués du tube de combustion par un flux d’hélium dans une colonne de réduction remplie de bouts de fil de cuivre. Cette colonne maintenue à 600 °C sert à piéger l’O2 de tout NOx dans le flux gazeux, convertissant ainsi tout le N en N2. Après avoir passé la colonne de réduction, le flux gazeux passe dans un piège à eau contenant du perchlorate de magnésium pour l’étape du séchage. Le flux gazeux passe ensuite dans un chromatographe en phase gazeuse, qui sépare le CO2 du N2, le N2 s’évacuant le premier de la colonne. Le CO2 et le N2 sont détectés à l’aide de détecteurs à conductivité thermique ou à l’aide de détecteurs IR.
Il existe des variantes à la méthode. On peut effectuer un prétraitement qui permet de mesurer tout le C présent dans les carbonates. Le prétraitement consiste à neutraliser les carbonates avec un acide puis à titrer par retour l’excès d’acide. Ce carbone est ensuite soustrait du C total pour donner le C organique. Une autre méthode d’élimination des carbonates consiste à traiter l’échantillon avec de l’acide dilué avant de procéder à la mesure du C. Une autre possibilité de séparer le C des carbonates du C de la matière organique est de recourir à la combustion à 860 °C ; elle a pour effet de ne décomposer que le carbone organique. Il est courant dans de nombreux laboratoires de déterminer le C total et le C organique selon la méthode de combustion sèche à l’aide d’instruments automatisés.
Perte au feu
La perte au feu (PAF) est la méthode qui procède par la mesure du changement de poids de l’échantillon une fois brûlée. Des substances s’éliminent soit en se volatilisant, soit par dégradation thermique, soit par combustion dans une atmosphère riche en oxygène. À n’importe quelle température, la PAF découlera de plusieurs processus:
- Perte d’humidité adsorbée sur les grains de minéral (principalement éliminée par chauffage à 105 °C).
- Perte d’eau de la structure interne des structures minérales (principalement éliminée par chauffage entre 600 et 1000 °C).
- Oxydation de la matière organique, généralement à ≤ 500 °C, avec production de CO2, de CO et de H2O.
- Décomposition thermique des minéraux carbonatés (p. ex., magnésite à 750 à 950 °C ou calcite à 850 à 950 °C) libérant du CO2.
- Oxydation des métaux (notamment Fe2+) en atmosphère riche en oxygène à laquelle on a ajouté des oxydes de fer.
Oxydation humide
Également connue sous le nom de méthode « Walkley Black », l’oxydation humide consiste à oxyder chimiquement le C organique de l’échantillon avec du chromate. L’oxydation est facilitée par la chaleur générée par l’ajout d’acide sulfurique. L’excès de chromate est déterminé par titrage et la quantité de carbone oxydé est calculée à partir de la quantité de chromate réduite. Cette méthode était auparavant la méthode standard de mesure du carbone organique du sol, mais elle souffre de plusieurs limitations. Il faut recourir à un facteur de correction de la mesure, car il y a oxydation incomplète du carbone présent dans un échantillon de sol. Cependant, ce facteur de correction peut varier selon le type de sol, ce qui entraîne un biais dans les résultats. Par exemple, le carbone présent sous forme de charbon de bois peut ne pas avoir été oxydé, ce qui pourrait mener à une sous-estimation du C total de l’échantillon de sol.
Matière organique du sol par rapport au carbone organique du sol et problème de conversion
Le carbone organique du sol (COS) et la matière organique du sol (MOS) ne s’équivalent pas en termes de quantité. Il est désormais presque automatique de faire la conversion entre SOC et SOM à partir de l’équation 3 :
(3)
Cette équation présume que les molécules de carbone représentent 58 % de la masse totale de la matière organique du sol. Cette proportion est basée sur les résultats de Waksman et Stevens (1930), qui n’ont pas manqué d’indiquer qu’il s’agissait d’un facteur de conversion à utiliser avec réserve. Par ailleurs, la matière organique du sol contient également des groupes fonctionnels contenant de l’hydrogène et de l’oxygène qui contribuent à la masse globale de matière organique du sol. Bien qu’on suppose également que l’hydrogène contribue pour environ 4 % et l’oxygène pour environ 30 % de la composition globale de la matière organique, on sait que ces proportions dépendent de l’état de décomposition de la matière organique du sol. En effet, on peut utiliser les indices d’hydrogène et d’oxygène appliqués initialement à la caractérisation pétrolière (Lafargue et al. 1998) pour déduire l’état de décomposition des sols (Gregorich et al. 2015 ; Sebag et al. 2006). La matière organique du sol constitue également une réserve importante de macroéléments cruciaux pour les besoins nutritionnels de plantes (c.-à-d. N, P et S). N, P et S sont généralement présents dans la matière organique du sol, mais en concentrations relativement faibles (<5 % pour N, <2 % pour P et S). Une revue critique du facteur de conversion couramment utilisé (Pribryl, 2010) a démontré que pour la majorité des études, ce facteur devrait être plus élevé que ce qu’il est. La figure 3.7 montre que le rapport réel entre la matière organique et sa teneur en C varie considérablement par rapport au facteur de conversion standard et est souvent plus élevé, c’est-à-dire que la proportion de C contenue dans la matière organique du sol y est plus faible.
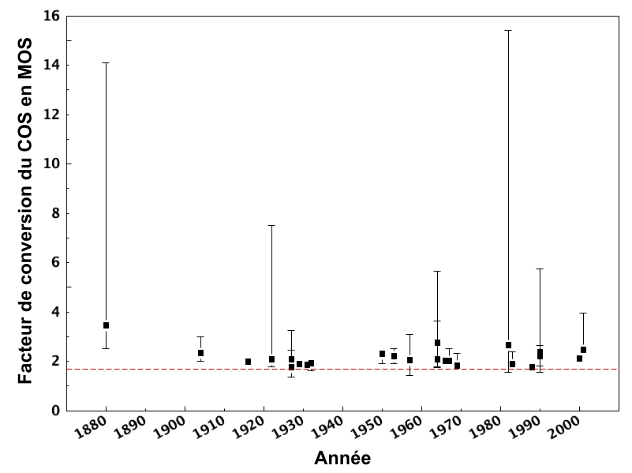
La meilleure méthode de conversion de la teneur en carbone organique contenue dans la matière organique en matière organique totale consisterait à les analyser séparément. Sinon, il faut savoir interpréter correctement les résultats des analyses compte tenu du facteur de conversion appliqué.
La question des carbonates
Le substratum rocheux paléozoïque à base de carbonates (calcaire) se trouve dans de nombreuses régions agricoles du Canada, principalement dans les provinces des Prairies et le long des Basses-Terres des Grands Lacs et du fleuve Saint-Laurent. Dans certaines régions, en particulier celles qui subissent de l’érosion causée par le travail du sol, on trouve des carbonates dans l’horizon de surface des sols de même que dans les horizons contenant le matériau parental d’origine. On a vu que les méthodes d’analyses basées sur la combustion décomposaient les carbonates en CO2, ce qui avait pour effet de surestimer le carbone organique de la matière organique. On distingue trois méthodes de différenciation du C du carbonate du C organique : 1) le traitement thermique ; 2) le traitement acide; et 3) l’oxydation humide (tableau 3.5).
Tableau 3.5. Méthodes de détection du C inorganique (c.-à-d. des carbonates) comme prétraitement à l’évaluation du C total ou organique d’un échantillon de sol.
| Méthode | Dispositions spécifiques | Avantages | Désavantages | |
|---|---|---|---|---|
| Traitement thermique | Mesure indirecte du carbone organique | Traitement simple et en vrac possible | Certains carbonates se décomposent à des températures plus basses | |
| our à moufle à 500ºC | Une certaine portion du carbone organique du sol résiste à 500ºC | |||
| Calcule le carbone organique du sol par différence | ||||
| Traitement à l’acide | Acidifie avec HCl | Traitement simple et en vrac | Durée de vie réduite de l’analyseur du C | |
| Acidifie avec H2SO3 (acide sulfureux) | Analyse fiable | Nécessite un appareil d’évaporation spécial | ||
| Oxydation humide | Réaction d’oxydo-réduction avec le chromate pour cibler seulement le carbone organique | Cible seulement le carbone organique | Le chromate est cancérigène | |
| Réaction d’oxydo-réduction avec d’autres composantes du sol |
Le traitement thermique est utilisé dans de nombreux laboratoires commerciaux. Dans ce cas, l’échantillon de sol est divisé en deux sous-échantillons. Le premier sous-échantillon, mesuré directement par combustion (voir la section Combustion sèche), donne une mesure du carbone total de ce sol. Le second, placé dans un four à moufle à environ 500 °C, n’élimine que le carbone organique, laissant derrière lui le carbone inorganique. On mesure ensuite ce sous-échantillon par combustion. Le carbone organique résulte du calcul de la différence entre les deux valeurs. Cette méthode mérite considération parce que les minéraux carbonatés communs dans les sols canadiens ont des températures de décomposition supérieures à 500 °C (c.-à-d. calcite > 700 °C, dolomie > 650 °C). Il existe cependant des sols qui contiennent de la sidérite, dont la température de décomposition est inférieure à 500 °C, soit environ 440 °C.
Le traitement à l’acide est fréquemment utilisé, car il coûte peu et ne nécessite pas d’appareil spécialisé. L’acide décompose les carbonates en eau et en CO2. On utilise deux acides en laboratoire : l’acide chlorhydrique et l’acide sulfureux. L’acide chlorhydrique a l’avantage d’être facile à utiliser, mais le désavantage de réduire la durée de vie des analyseurs du carbone. L’acide sulfureux offre l’avantage d’être volatil ; il s’évapore après utilisation. Cependant, son utilisation nécessite de la ventilation et des manipulations appropriées (Baldock et Skjemstad, 2008).
L’oxydation humide, comme mentionnée ci-dessus, est une méthode qui cible seulement le carbone organique. Les carbonates éventuellement présents dans l’échantillon ne participent pas à la réaction, car ils sont déjà totalement oxydés. Cette méthode est cependant basée sur l’utilisation d’acides chromiques cancérigènes qui peuvent également participer à d’autres réactions redox, biaisant ainsi les estimations du carbone organique.
Soil Organic Matter Composition
En plus de mesurer les formes de carbone du sol pour le quantifier, on peut aussi déterminer la composition de la matière organique du sol. Dans de nombreux cas, il importe de connaître la composition de la matière organique du sol pour mieux comprendre le cycle du carbone, de l’azote et de l’oxygène, ainsi que la santé du sol. Dès lors, il devient de plus en plus important de compléter les mesures du carbone du sol avec des mesures de pointe sur la composition de la matière organique du sol. Cependant, sa nature complexe rend difficile l’évaluation de sa composition. Comme nous l’avons vu précédemment dans ce chapitre, la matière organique du sol est un mélange complexe de composés de tailles, de polarités et de stades d’oxydation (biodégradation) variés. Ce continuum de composés organiques rend difficiles l’isolement et la caractérisation de la composition de la matière organique du sol ; c’est pourquoi, dans de nombreux cas, les scientifiques utilisent des méthodes qui fournissent de l’information à l’échelle atomique ou moléculaire (Kögel-Knabner, 2000 ; Simpson et Simpson, 2012 ; Derenne et Nguyen Tu, 2014). Pour cette raison, le recours à des méthodes d’extraction par fractionnement se révèle le plus souvent utilisé. L’une de ces méthodes base son fractionnement sur la solubilité de la matière organique, d’abord dans une base forte puis dans un acide fort, ce qui donne trois fractions (acide fulvique, acide humique et humine) que l’on caractérise ensuite en recourant à d’autres techniques. La principale critique attribuée à cette méthode porte sur la nature des fractions, dont on dit qu’elles ne sont pas représentatives des processus « biogéochimiquement » pertinents qui se produisent dans l’environnement du sol (Lehmann et Kleber, 2015). Une autre méthode de fractionnement de la matière organique du sol base le fractionnement de la matière organique sur la densité ; les particules de matière organique se trouvent séparées en fonction de leur taille (granulométrie, p. ex., de sable, de limon et d’argile [Gregorich et al. 1996]). D’autres méthodes basées sur le fractionnement physique sont de plus en plus utilisées, car elles sont considérées comme étant très représentatives du cycle biogéochimique de la matière organique du sol (Mikutta et al. 2006 ; Sollins et al. 2009 ; Hatton et al. 2012). Par exemple, la fraction de matière organique particulaire (également appelée fraction légère) a un cycle rapide et est facilement accessible aux microorganismes, tandis que la fraction argileuse contient de la matière organique du sol qui peut ne pas être active sur le plan biogéochimique, mais qui représente la partie de la matière organique du sol qui persiste dans le sol. Des agrégats de sol de différentes tailles peuvent également être isolés et étudiés en fonction des questions de recherche ou des objectifs de l’analyse.
Au cours des dernières décennies, on a mis au point de nombreuses autres méthodes de pointe qui ont servi à étudier la composition de la matière organique présente dans un profil de sol entier et dans des fractions du sol. Toutes ces méthodes ont permis d’améliorer notre compréhension de la chimie de la matière organique du sol et de sa persistance dans l’environnement. Par ailleurs, des méthodes qui font appel à l’analyse par spectrométrie de masse et par spectroscopie de résonance magnétique nucléaire — couramment utilisés en chimie — nous ont permis de comprendre la composition de la matière organique du sol à l’échelle moléculaire (Kögel-Knabner 2000 ; Simpson et Simpson 2012 ; Derenne et Nguyen Tu 2014 ; Simpson et al. 2018). Les méthodes de spectrométrie de masse couplées à des techniques de chromatographie permettent de séparer les composés avant qu’ils soient analysés par le spectromètre de masse. Ces méthodes ont permis aux chercheurs d’éclaircir une partie de la complexité moléculaire de la matière organique du sol et de détecter également des composés qui lui sont propres. La spectrométrie de masse est aussi utilisée pour mesurer différents isotopes stables et radiogéniques d’éléments importants tels que le carbone, l’azote et l’oxygène. Les isotopes stables peuvent fournir de l’information sur les différentes sources végétales et sur le degré de transformation microbienne de la matière organique (par mesure du fractionnement isotopique [Whalen et al. 2014 ; Kohl et al. 2015]), tandis que les mesures isotopiques radiogéniques du carbone (radiocarbone) fournissent de l’information sur l’« âge » de la matière organique, information utile à la compréhension des mécanismes de persistance (Trumbore et Druffel 1995 ; Quideau et al. 2000).
La spectroscopie par résonance magnétique nucléaire est une autre méthode qui a livré un aperçu sans précédent de la composition de la matière organique du sol. Cette méthode donne la possibilité d’analyser des échantillons à l’état solide ou en solution, ce qui est idéal pour l’analyse de sols entiers et de diverses fractions de sol (insolubles ou solubles), car elle fournit de l’information à l’échelle moléculaire sur toutes les structures présentes (figure 3.8). Le Centre canadien de rayonnement synchrotron à l’Université de la Saskatchewan est un centre de recherche national où l’on applique les méthodes d’analyse de pointe par lumière synchrotron à la détermination de la composition de la matière organique du sol. Ces méthodes de rayonnement synchrotron peuvent être considérées comme de puissants rayons X qui fournissent de l’information sur la composition de différents éléments de la matière, comme celle d’un sol. Elles peuvent également fournir de l’information sur les interactions entre la matière organique, les argiles et d’autres matériaux présents dans le sol (Gillespie et al. 2015). Toutes ces méthodes combinées à l’avènement de technologies de pointe ont permis d’accélérer notre compréhension de la composition de la matière organique du sol et des mécanismes sous-jacents qui gouvernent sa stabilité dans l’environnement.
Les activités de recherche à venir porteront sur l’élaboration et l’application de nouvelles méthodes/techniques d’évaluation de la matière organique du sol qui permettront de mieux comprendre son caractère durable.
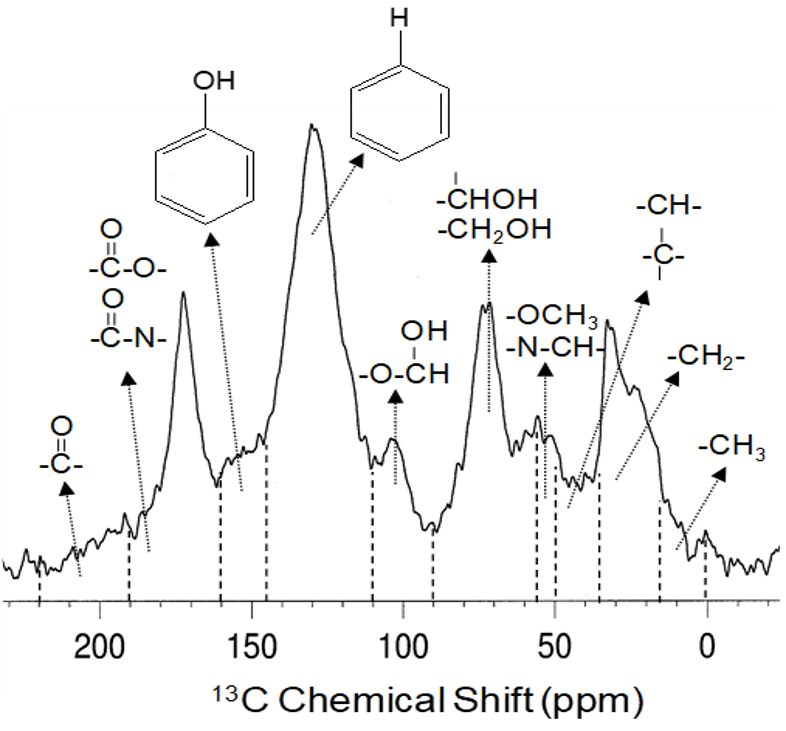
Depuis plusieurs décennies déjà, on utilise la spectroscopie par résonance magnétique nucléaire (RMN) pour étudier la composition de la matière organique du sol. Il existe de nombreux types d’expériences RMN (voir Simpson et al. 2018 pour en savoir plus), mais le type le plus couramment appliqué en science du sol est la RMN du 13C à l’état solide (Preston et al. 1997). Cette technique permet d’analyser toutes les formes de carbone dans la matière organique du sol, qu’il s’agisse d’un échantillon de sol entier ou d’un échantillon de ses différentes fractions. La figure 3.8 donne un exemple de spectre RMN du 13C (de Simpson et Simpson [2012]) d’un horizon Ah d’un chernozem noir orthique (série de sols malmo) où l’on peut observer les différents constituants moléculaires détectés par l’appareil. Le tableau 3.6 présente ces constituants moléculaires et les macromolécules de matière organique du sol dont elles proviennent. À partir de ces constituants moléculaires, les chercheurs peuvent ainsi différentier les composés d’origine végétale et ceux d’origine microbienne qui entrent dans la composition de la matière organique du sol et peuvent étudier son processus de renouvellement et de préservation.
Tableau 3.6. Affectation des déplacements chimiques par résonance magnétique nucléaire (RMN) du 13C et relation avec les constituants moléculaires de la matière organique du sol selon le spectre RMN du chernozem noir orthique (horizon Ah). Affectations de déplacement chimique compilées à partir de Baldock et al. (1992) ; Preston et al. (1997) ; Salloum et al. (2002); et Simpson et Simpson (2012).
| Plage de déplacement chimique (ppm) | Constituant moléculaire | Macromolécules de matière organique du sol |
|---|---|---|
| 0-45 ppm | Carbone alkyle non substitué : comprend le carbone du méthylène à chaîne droite (30-34 ppm) et les groupes méthyle terminaux (15 ppm). Le carbone du méthylène ramifié se trouve plus en aval (35-45 ppm) | Lipids, cutin, suberin, lignin side chains, amino acids/peptides |
| 45-65 ppm | Carbone alkyle substitué tel que celui trouvé dans les amines (45-46 ppm) et les groupes méthoxyle (56 ppm) | Lipids, lignin |
| 65-95 ppm | Carbone substitué par de l’oxygène, carbones cycliques dans les glucides et carbones dans les éthers | Cellulose and simple sugars, amino acids/peptides, chitin |
| 95-110 ppm | Carbone aliphatique à substitution dioxygène et carbone anomérique dans les glucides (105 ppm) | Cellulose and simple sugars |
| 110-145 ppm | Carbone aromatique | Black carbon/biochar, lignin and aromatic amino acids |
| 145-160 ppm | Carbone phénolique | Lignine, subérine |
| 160-220 ppm | Carbone carboxylique, amide et ester, carbone carbonyle | Lipids (including fatty acids), cutin, suberin, and amino acids/peptides |
MATIÈRE ORGANIQUE DES SOLS ET ENJEUX MONDIAUX
Cycle mondial du carbone
L’augmentation des concentrations de CO2 dans l’atmosphère a attiré l’attention sur le rôle majeur que jouent les sols dans le cycle mondial du carbone. Étant donné que les sols constituent la plus grande réserve terrestre de carbone, les scientifiques et les décideurs politiques ont préconisé d’augmenter la séquestration du carbone dans le sol comme moyen de réduire une partie du CO2 de l’atmosphère.
Les stocks de carbone du sol sont le plus souvent exprimés en kilogrammes (kg or 103 g) ou en pétagrammes (Pg ou 1015 g). Parfois, la gigatonne (Gt) est utilisée comme unité ; notez qu’une Gt = un Pg. Les stocks portent sur la quantité totale de carbone contenue jusqu’à une profondeur donnée (p. ex., les 30 premiers cm ou 50 cm du sol). Cependant, il existe encore de grandes incertitudes concernant les estimations des stocks mondiaux de carbone des sols. Ces incertitudes sont liées aux limites des données sur les stocks de carbone en profondeur (en dessous de 30 cm, à 1 m ou à 3 m de profondeur), ainsi qu’aux limites des données en provenance de certaines zones géographiques (comme dans les sols nordiques en haute altitude). De plus, les stocks de carbone du sol restent difficiles à modéliser avec précision, car ils dépendent des effets interactifs de plusieurs facteurs environnementaux, à savoir le climat, la végétation et le matériau géologique d’origine du sol.
En 2017, l’Organisation des Nations Unies pour l’alimentation et l’agriculture (FAO) a lancé l’initiative de la Carte mondiale du carbone organique des sols (GSOCmap). Plus de 100 pays ont contribué à produire la première carte mondiale des sols jamais produite à partir de cartes nationales harmonisées des sols. Cette carte est accessible en passant par le portail GSOCmap. Si l’on se base sur ces données, les stocks mondiaux de carbone organique du sol dans la couche arable (0-30 cm) sont estimés à 680 pétagrammes (Pg). Plus de 70 % de ces stocks se trouvent dans 14 pays, le pays ayant les plus grands stocks étant la Russie (147,9 Pg — 21,9 %), suivie du Canada (80,2 Pg — 11,9 %) et des États-Unis (54,4 Pg — 8,0 %).
La majorité des stocks mondiaux de carbone du sol se situe en dessous de 30 cm. Il est estimé qu’en moyenne, il y a 1 505 Pg de C d’emmagasinés jusqu’à 1 m de profondeur et jusqu’à 3 444 Pg de C entre 0 et 3 m. C’est plus que ce que l’atmosphère et la végétation combinées peuvent emmagasiner.
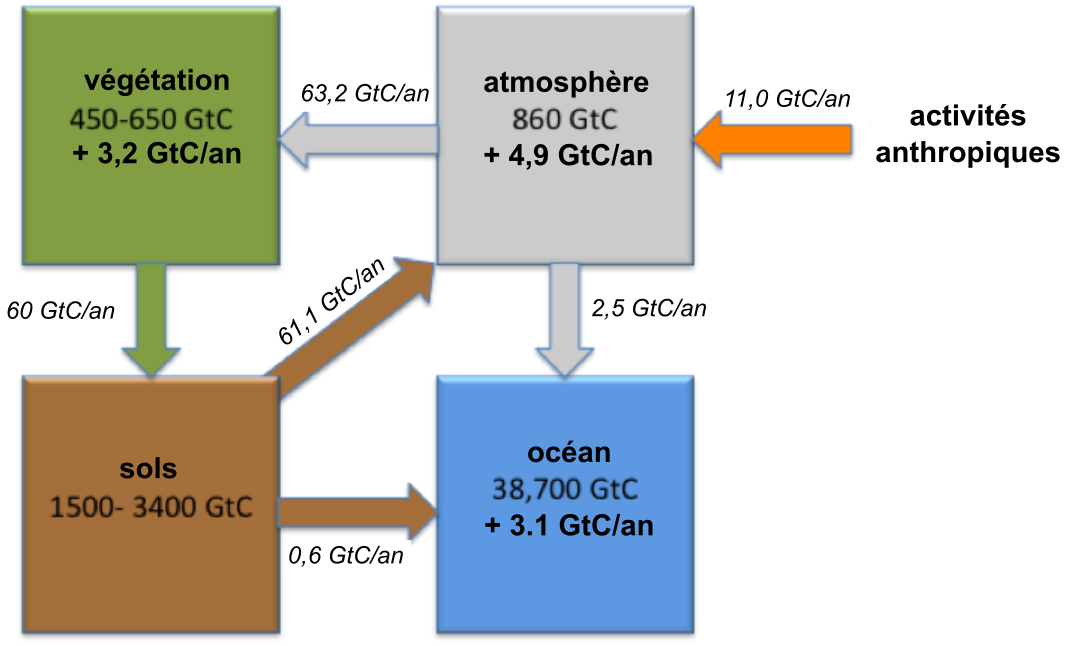
Les activités agricoles et le changement d’affectation des terres représentent environ 25 % des émissions anthropiques de CO2. La séquestration supplémentaire de carbone dans les sols pourrait aider à compenser ces émissions. L’initiative « 4 pour mille — Les sols pour la sécurité alimentaire et le climat » (également connue sous l’acronyme 4p1000 ou 4 pour mille) a été lancée en 2015 lors de la COP21, soit la « 21e Conférence des parties » de la Convention-cadre des Nations Unies sur les changements climatiques (CCNUCC). Cette initiative vise à compenser l’augmentation actuelle du CO2 atmosphérique par l’augmentation des stocks mondiaux de carbone du sol de 4 pour 1000 (ou 0,4 %) par an (voir 4p1000). L’agriculture et les changements d’affectation des terres qui y sont associés contribuent à un peu moins de 15 % des émissions anthropiques totales de CO2 dans l’atmosphère (figure 3.9).
Changement climatique et carbone du sol
Les changements climatiques sont en train de modifier de nombreux processus biogéochimiques sur la planète. Les changements de température et d’humidité se répercutent sur la quantité et la qualité des apports végétaux au sol, sur l’activité des microorganismes, leur diversité et leur utilisation des substrats organiques (Melillo et al. 2017 ; Pold et al. 2017 ; Lajtha et al. 2018). Comme mentionné à maintes reprises, les sols constituent un réservoir majeur et potentiellement un puits important de carbone dans le cycle biogéochimique du carbone à l’échelle globale. Cependant, les changements climatiques ont pour effet de transformer les puits de carbone en sources, en raison de l’altération fondamentale des processus qui régulent le stockage du carbone dans le sol. En effet, des expériences de réchauffement du sol ont montré que le réchauffement pouvait favoriser l’activité microbienne, ce qui a pour effet d’augmenter la dégradation de la matière organique du sol et de diminuer la quantité totale de carbone qui y était stockée (Melillo et al. 2017).
Les écosystèmes sensibles trouvés dans l’Arctique sont particulièrement vulnérables à ce phénomène, en raison du dégel du pergélisol qui exporte le carbone précédemment inerte vers des zones biogéochimiquement actives (Schuur et al. 2015). Qui plus est, l’augmentation de la fréquence et de l’intensité des incendies dans la forêt boréale augmente les pertes de carbone du sol et par conséquent menace la capacité de ce biome à agir comme puits de carbone (Walker et al. 2019). Les prévisions actuelles montrent une perte mondiale de carbone du sol qui découle de l’augmentation de la respiration dans tous les écosystèmes (Bond-Lamberty et al. 2018). Les scientifiques étudient activement la sensibilité du carbone du sol aux impacts des changements climatiques dans l’espoir de déterminer des façons de préserver ces importants stocks de carbone. L’avenir du carbone du sol reste incertain et les pertes continues de matière organique du sol peuvent entraîner une baisse généralisée de la fertilité et de la santé des sols. Mieux comprendre la nature de la matière organique y compris ses capacités de persistance et la façon dont elle est affectée par les changements climatiques permettra l’élaboration de stratégies d’atténuation informées qui permettront de préserver et de protéger le carbone du sol.
Matière à réflexion !
Vers de terre : amis ou ennemis ?
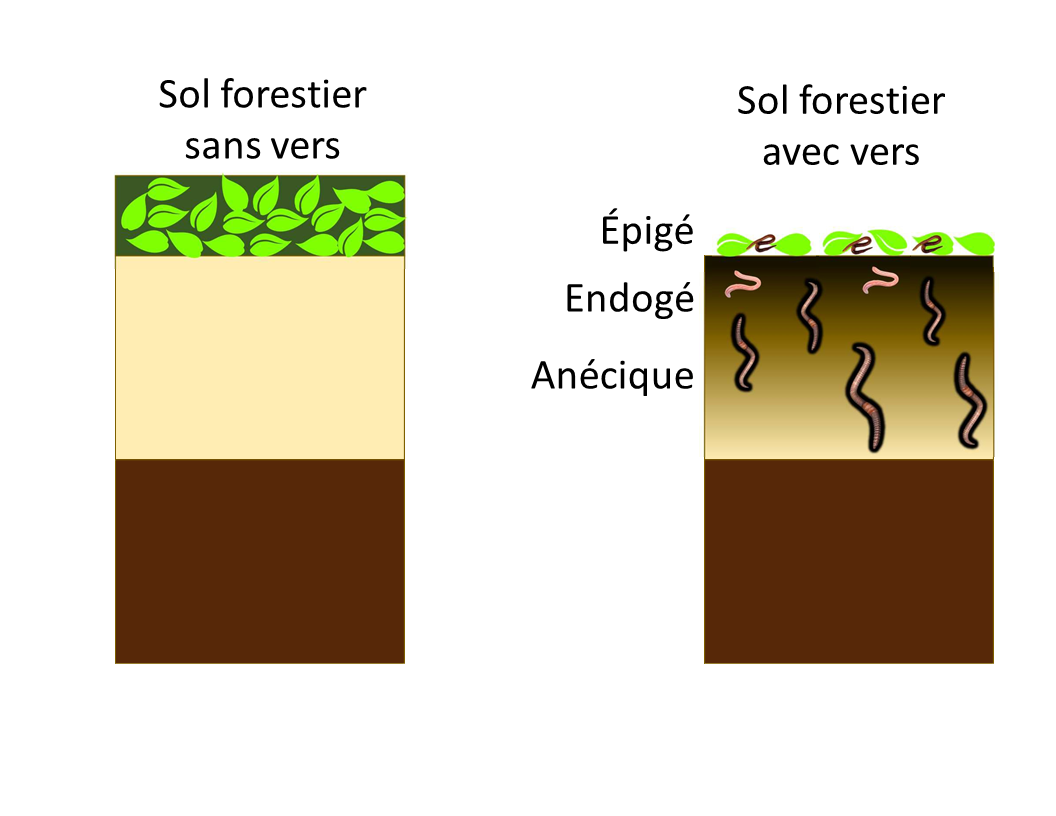
Les effets bénéfiques des vers de terre sur la fertilité des sols sont nombreux. Dans les sols agricoles, on a observé qu’ils augmentent les stocks de matière organique, diminuent la densité apparente, et favorisent le drainage et le rendement des cultures.
Cependant, dans les sols de la forêt boréale du Canada, où ils ne font pas partie des communautés biologiques indigènes, ils modifient rapidement la répartition des stocks de carbone du sol.
Les stocks mondiaux de carbone estimés dans les sols boréaux varient entre 367 et 1716 Pg, avec une valeur médiane à 1095 Pg. Environ un tiers de toutes les forêts boréales se trouve au Canada. L’invasion des vers de terre entraîne la réduction, sinon la disparition de la couverture morte et le transfert d’une partie de ce carbone au sol minéral. À court terme, l’invasion des vers de terre peut entraîner une libération nette de carbone dans l’atmosphère. À plus long terme, on en ignore l’impact exact.
Matière à réflexion !
Chercheurs canadiens d’importance sur la matière organique du sol
Dr. Caroline Preston, Ph. D., Centre de foresterie du Pacifique, Ressources naturelles Canada.

Caroline Preston est une spécialiste de la chimie du sol. Elle est considérée comme l’une des premières à avoir appliqué la méthode du 13C-RMN à l’étude de la structure complexe de la matière organique du sol dans les sols agricoles et forestiers.
Elle a intégré les aspects suivants dans son programme de recherche : améliorer la compréhension du cycle du C, N et P dans le sol et utiliser cette connaissance en vue d’améliorer celle sur le stockage du C (implications sur les changements climatiques) et sur la gestion du N et du P dans le sol et, plus important encore appliquer les méthodes spectroscopiques (13C-RMN en particulier) à la science du sol. Parmi ses nombreuses contributions, notons son travail sur les structures chimiques des charbons de feux de forêt. Sa compréhension de l’écosystème sol combinée à la méthodologie de la RMN lui ont permis d’élaborer un corpus de recherche innovant et très influent, qui a fait avancer dans le monde entier notre compréhension de la matière organique du sol. Mme Preston a obtenu son diplôme de premier cycle en chimie à l’Université McMaster (1970) et son diplôme de deuxième cycle à l’Université de la Colombie-Britannique (1975). En 1991, elle a été élue membre de l’Institut de chimie du Canada. En 1992, Mme Preston a reçu le prix Barringer « Application de la spectroscopie de la Société de spectroscopie du Canada ». Elle est de plus membre de la Société canadienne des sciences du sol.
Dr. Morris Schnitzer, Agriculture et Agroalimentaire Canada

M. Schnitzer est l’un des premiers chimistes du sol à avoir étudié la matière organique du sol. Ses contributions dans ce domaine sont sans précédent, les principales ayant été centrées sur les méthodes analytiques d’extraction, de caractérisation et de modélisation des substances humiques. Beaucoup le considèrent comme le grand-père de l’étude des substances humiques ; son dossier de publication comprend plus de 350 articles révisés par les pairs et de nombreux livres. Il est né dans une famille juive en Allemagne et a fui les nazis durant la guerre. Cette odyssée a été détaillée dans son autobiographie. Il s’est établi à Montréal où il a étudié la chimie des sols où a été le premier à appliquer la chromatographie en phase gazeuse, la spectrométrie de masse et la RMN à l’étude de la matière organique du sol. Par exemple, dans les années 1960, il a commencé une étude à long terme sur la dégradation oxydative des substances humiques et des sols en développant l’une des premières méthodes d’analyse par chromatographie en phase gazeuse et spectrométrie de masse. N’ayant jamais eu peur de la controverse, il n’a pas hésité à utiliser la spectrométrie de masse par pyrolyse, ce qui lui a permis d’étayer sa théorie de la prévalence des structures contenant de l’azote dans la matière organique du sol. Le chercheur Schnitzer a obtenu son B.Sc. avec les honneurs de première classe en 1951, sa M.Sc. en 1952 et son Ph.D. en 1955, tous de l’Université McGill en chimie des sols. Il est membre de la Société canadienne des sciences du sol, de la Soil Science Society of America, de l’American Society of Agronomy et de la Société royale du Canada.
Dr. Con (Constantine) Campbell, Agriculture et Agroalimentaire Canada

Con Campbell est reconnu dans le monde entier comme étant l’un des plus grands spécialistes de la matière organique du sol et de tous les aspects qui concernent l’azote dans les sols et les cultures. Grâce à ses recherches, il a montré que la matière organique du sol est un indicateur environnemental clé de l’état de santé des sols des prairies ; ses recherches ont retenu l’attention à l’échelle nationale et internationale et sont utilisées dans le développement et la mise à l’essai de modèles de croissance des plantes. Les contributions hors du commun de M. Campbell ont été reconnues par l’Ordre du Canada et l’Ordre du mérite de la Saskatchewan. Dans ses recherches, il a été l’un des premiers à utiliser la datation au carbone pour mesurer la dynamique du renouvellement de la matière organique du sol. Il a mené des études qui ont aidé à faire progresser le concept de l’azote potentiellement « minéralisable », fournissant ainsi une base de recherche sur l’optimisation de l’usage d’engrais azoté dans les prairies canadiennes. Con Campbell est né à Montego Bay, en Jamaïque, où il a obtenu son diplôme du Cornwall College avant d’obtenir son BSA en 1960 et son MSA en sciences du sol de l’Ontario Agricultural College à l’Université de Toronto en 1961. Il a obtenu son doctorat à l’Université de la Saskatchewan en 1965 et s’est immédiatement joint à la Swift Current Research Station à titre de chercheur scientifique. Il est membre de la Société canadienne des sciences du sol, de l’Institut agricole du Canada, de la Soil Science Society of America et de l’American Society of Agronomy.
SOMMAIRE
- La matière organique est l’une des composantes les plus importantes du sol. Sa présence a pour effet de diminuer la densité apparente du sol, d’augmenter sa rétention d’eau, sa capacité d’échange cationique et sa capacité tampon. La matière organique est au cœur du cycle biogéochimique de nombreux éléments nutritifs des plantes et contribue à maintenir la grande biodiversité présente dans les sols.
- Les sols contiennent à la fois du carbone organique et inorganique. Il existe plusieurs méthodes pour mesurer le carbone total et le carbone organique du sol. Le carbone organique est le principal élément de la matière organique du sol. La conversion des valeurs du carbone organique en valeurs de matière organique doit être appliquée avec réserve.
- Les résidus végétaux constituent la matière de base de formation de la matière organique du sol. La matière organique du sol est composée de ces résidus à divers stades de décomposition et contient également, dans certains cas, une grande quantité de la biomasse faunique et microbienne morte et des produits de synthèse microbienne.
- Les sols stockent de grandes quantités de carbone, plus de deux fois la quantité de carbone contenu dans l’ensemble de l’atmosphère et la végétation réunis. Le carbone du sol n’est pas réparti uniformément sur le territoire, mais varie plutôt en fonction des facteurs de formation du sol.
- La majorité du carbone du sol au Canada est contenue dans les cryosols et les sols organiques où la température froide inhibe les pertes de carbone par décomposition.
- La mise en culture des Prairies canadiennes a causé la perte d’environ un quart du carbone contenu dans ses sols. Une partie de ce carbone du sol peut être restaurée en recourant à des pratiques d’agriculture de conservation et en intégrant des plantes vivaces.
EXERCICES PRATIQUES
- D’où vient la matière organique du sol ?
- Quelles relations peut-on établir entre la matière organique du sol et les éléments majeurs (carbone, oxygène et azote) ?
- Comment la matière organique du sol contribue-t-elle à la capacité totale d’échange cationique du sol ?
- Quels sont les facteurs environnementaux qui déterminent la persistance de la matière organique du sol dans différentes régions du Canada ?
- Qu’arrive-t-il aux intrants végétaux (résidus frais) lorsqu’ils sont ajoutés au sol ? Où va le carbone ?
- Compte tenu de certains principes d’oxydo-réduction de base, pourquoi les microorganismes préfèrent-ils certaines formes de matière organique du sol plutôt que d’autres à titre de substrat ?
- Comment mesure-t-on la teneur en matière organique d’un échantillon de sol ?
- Quels types de méthodes/techniques/appareils permettent d’évaluer la composition de la matière organique du sol ? Décrivez ces méthodes/techniques/appareils au regard de leur accessibilité, facilité d’utilisation et de la qualité des mesures qu’elles fournissent sur la composition de la matière organique du sol.
RÉFÉRENCES
Bailey, V. L., Pries, C. H. and Lajtha, K. 2019. What do we know about soil carbon destabilization?. Environ. Res. Lett. 14: 083004. doi: 10.1088/1748-9326/ab2c11.
Baldock, J.A., Oades, J.M., Waters, A.G., Peng, X., Vassallo, A.M., and Wilson, M.A. 1992. Aspects of the chemical structure of soil organic materials as revealed by solid-state 13C NMR spectroscopy. Biogeochemistry 16 : 1–42.
Baldock, J.A. and Skjemstad, J.O. 2000. Role of the soil matrix and minerals in protecting natural organic materials against biological attack. Org. Geochem. 31: 697–710. doi: 10.1016/S0146-6380(00)00049-8.
Bohn, H.L., McNeal, B.L. and O’Connor, G.A. 1985. Soil Chemistry. 2nd edn. New York, Wiley.
Bond-Lamberty, B., Bailey, V.L., Chen, M., Gough, C.M. and Vargas, R. 2018. Globally rising soil heterotrophic respiration over recent decades. Nature 560: 80–83. doi: 10.1038/s41586-018-0358-x.
Cotrufo, M. F., Wallenstein, M.D., Boot, C.M., Denef, K. and Paul, E. 2013. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter? Glob. Change Biol. 19: 988-995. doi: 10.1111/gcb.12113.
Derenne, S. and Nguyen Tu, T. T. 2014. Characterizing the molecular structure of organic matter from natural environments: An analytical challenge. C. R. Geosci. 346: 53–63. doi: 10.1016/j.crte.2014.02.005.
Feng, X., Simpson, A.J. and Simpson, M.J. 2005. Chemical and mineralogical controls on humic acid sorption to clay mineral surfaces. Org. Geochem. 36: 1553–1566. doi: 10.1016/j.orggeochem.2005.06.008.
Friedlingstein, P, Jones, M W, O’Sullivan, M et al. 2019. Global carbon budget 2019. Earth System Science Data 11: 1783-1838.
Gillespie, A.W., Philips, C.L., Dynes, J.J., Chevrier, D., Regier, T.Z. and Peak, D. 2015. Advances in using soft x-ray spectroscopy for measurement of soil biogeochemical processes. Adv. Agron. 133:1–32. doi: 10.1016/bs.agron.2015.05.003.
Gregorich, E.G., Gillespie, A.W., Beare, M.H., Curtin, D., Sanei, H., Yanni, S.F., 2015. Evaluating biodegradability of soil organic matter by its thermal stability and chemical composition. Soil Biology and Biochemistry 91, 182–191. https://doi.org/10.1016/j.soilbio.2015.08.032
Gregorich, E. G., Monreal, C.M., Schnitzer, M. and Schulten, H.R. 1996. Transformation of plant residues into soil organic matter: Chemical characterization of plant tissue, isolated soil fractions, and whole soils. Soil Sci 161: 680–693. doi: 10.1097/00010694-199610000-00005.
Hatton, P.J., Kleber, M., Zeller, B., Moni, C., Plante, A.f., Townsend, K., Gelhaye, L., Lajtha, K, and Derrien, D. 2012. Transfer of litter-derived N to soil mineral-organic associations: evidence from decadal 15N tracer experiments. Org. Geochem 42: 1489–1501. doi: 10.1016/j.orggeochem.2011.05.002.
Horwath, W.R. and Kuzyakov, Y. 2018. The potential for soils to mitigate climate change through carbon sequestration. Dev. Soil Sci. 35: 61-92. doi: 10.1016/b978-0-444-63865-6.00003-x.
Janzen, H.H., Campbell, C.A., Gregorich, E.G. and Ellert, B.H. 2018. Soil carbon dynamics in canadian agroecosystems. Pages 57-80 in R., Lal, J.M. Kimble, R.F. Follett and B.A. Stewart, eds. Soil Processes and the Carbon Cycle. CRC Press, Boca Raton, Fla. doi: 10.1201/9780203739273.
Jenny, H. 1941. Factors of Soil Formation. McGraw-Hill, New York. doi: 10.1097/00010694-194111000-00009.
Kelleher, B. P. and Simpson, A. J. 2006. Humic substances in soils: Are hey really chemically distinct? Environ. Sci. Technol. 40: 4605–4611. doi: 10.1021/es0608085.
Kleber, M., Sollins, P. and Sutton, R. 2007. A conceptual model of organo-mineral interactions in soils: self-assembly of organic molecular fragments into zonal structures on mineral surfaces. Biogeochemistry 85: 9–24. doi: 10.1007/s10533-007-9103-5.
Kögel-Knabner, I. 2000. Analytical approaches for characterizing soil organic matter. Org. Geochem. 31: 609–625. doi: 10.1016/S0146-6380(00)00042-5.
Kögel-Knabner, I. 2002. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter. Soil Biol. Biochem. 34: 139–162. doi: 10.1016/S0038-0717(01)00158-4.
Kögel-Knabner, I. and Amelung, W. 2014. Dynamics, chemistry, and preservation of organic matter in soils. pp. 157-215 In H.D. Holland and K.K. Turekian (eds), Treatise on Geochemistry, Second Edition, vol. 12, Elsevier, Oxford. . doi: 10.1016/B978-0-08-095975-7.01012-3.
Kohl, L., Laganiere, J., Edwards, K.A., Billings, S.A., Morrill, P.L. Van Biesen, G. and Ziegler, S.E. 2015. Distinct fungal and bacterial δ13C signatures as potential drivers of increasing δ13C of soil organic matter with depth. Biogeochemistry 124: 13–26. doi: 10.1007/s10533-015-0107-2.
Kuzyakov, Y., Friedel, J. , and Stahr, K. 2000. Review of mechanisms and quantification of priming effects. Soil Biol. Biochem. 32: 1485–1498. doi: 10.1016/S0038-0717(00)00084-5.
Lafargue, E., Marquis, F., Pillot, D., 1998. Rock-Eval 6 applications in hydrocarbon exploration, production, and soil contamination studies. Revue de l’Institut Francais du Petrole 53, 421–437.
Laganière, J., Angers, D. A. and Paré, D. 2010. Carbon accumulation in agricultural soils after afforestation: A meta-analysis. Glob. Change Biol. 16: 439–453. doi: 10.1111/j.1365-2486.2009.01930.x.
Lajtha, K., Bowden, r.D., Crow, S., Fekete, I., Kotroczo, Z., Plante, A., Simpson, M.J. and Nadelhoffer, K.J. 2018. The detrital input and removal treatment (DIRT) network: Insights into soil carbon stabilization. Sci. Total Environ. 640–641: 1112–1120. doi: 10.1016/j.scitotenv.2018.05.388.
Lal, R. 2018. Digging deeper: A holistic perspective of factors affecting soil organic carbon sequestration in agroecosystems. Glob. Change Biol. 24: 3285-3301. doi: 10.1111/gcb.14054.
Lehmann, J. and Kleber, M. 2015. The contentious nature of soil organic matter. Nature 528: 60–68. doi: 10.1038/nature16069.
Mary, B., Clivot, H., Blaszczyk, N., Labreuche, J. and Ferchaud, F. 2020. Soil carbon storage and mineralization rates are affected by carbon inputs rather than physical disturbance: Evidence from a 47-year tillage experiment. Agr. Ecosys. Environ. 299: 106972. doi: 10.1016/j.agee.2020.106972.
Mayer, M. Prescott, C., Abaker, W.E.A., Augusto, L., Cécillon, L., Ferreira, G.W.D., James, J., Jandl, R., Katzensteiner, K., Laclau, J.-P., Laganière, J., Nouvellon, Y.; Paré, D., Stanturf, J.A., ,Vanguelova, E.I. and Vesterdal, L.2020. Influence of forest management activities on soil organic carbon stocks: A knowledge synthesis. Forest Ecol. Manag. 466: 118127. doi: 10.1016/j.foreco.2020.118127.
Melillo, J. M., Frey, s.D., DeAngelis, K.M., Werner, W.J., Bernard, M.J., Bowles, F.P., Pold, G., Knorr, M.A. and Grandy, A.S. 2017. Long-term pattern and magnitude of soil carbon feedback to the climate system in a warming world. Science 358: 101–105. doi: 10.1126/science.aan2874.
Mikutta, R., Kleber, M., Torn, M.S. and Jahn, R. 2006. Stabilization of soil organic matter: Association with minerals or chemical recalcitrance?. Biogeochemistry 77: 25–56. doi: 10.1007/s10533-005-0712-6.
Oades, J.M. 1988. The retention of organic matter in soils. Biogeochemistry 5: 35–70. doi: 10.1007/BF02180317.
Ohlson, M., Dahlberg, B., Okland, T., Brown, K.J. and Havorsen, R. 2009. The charcoal carbon pool in boreal forest soils. Nature Geoscience 2: 692-695. doi: 10.1038/ngeo617.
Pold, G., Grandy, A.S., Melillo, J.M. and DeAngelis, K.M 2017. Changes in substrate availability drive carbon cycle response to chronic warming. Soil Biol. Biochem. 110: 68–78. doi: 10.1016/j.soilbio.2017.03.002.
Prescott, C.E., Frouz, J., Grayston, S.J., Quideau, S.A. and Straker, J. 2019. Rehabilitating forest soils after disturbance. Developments in Soil Science 36: 309-343.doi: 10.1016/b978-0-444-63998-1.00013-6.
Preston, C.M., Trofymow, J.A., Niu, J. and Sayer, B.G. 1997. 13C nuclear magnetic resonance spectroscopy with cross-polarization and magic-angle spinning investigation of the proximate-analysis fractions used to assess litter quality in decomposition studies. Can. J. Bot. 75: 1601–1613. doi: 10.1139/b97-872.
Pribyl, D.W. 2010 A critical review of the conventional SOC to SOM conversion factor. Geoderma. 156:75-83, doi:10.1016/j.geoderma.2010.02.003
Quideau, S.A., Anderson, M.A., Graham R.C., Chadwick, O.A. and Trumbore, S.E. 2000. Soil organic matter processes: characterization by 13C NMR and 14C measurements.Forest Ecol. Manag. 138: 19–27. doi: 10.1016/S0378-1127(00)00409-6.
Ricklefs, R.E. 2008. The Economy Of Nature. W. H. Freeman and Company, New York.
Salloum, M.J., Chefetz, B. and Hatcher, P. G. 2002. Phenanthrene sorption by aliphatic-rich natural organic matter. Environ. Sci. Technol. 36:. doi: 10.1021/es015796w.
Schmidt, M.W., Torn, M.S., Abiven, S., Dittmar, T., Guggenberger, G., Janssens, I.A., Kleber, M., Kögel-Knabner, I., Lehmann, J., Manning, D.A.C.,Nannipieri, P., Rasse, D.P., Weiner, S. and Trumbore, S.E. 2011. Persistence of soil organic matter as an ecosystem property. Nature 478: 49–56. doi: 10.1038/nature10386.
Schuur, E.A.G. McGuire, A.D., Schädel, C., Grosse, G., Harden, J.W., Hayes, D.J., Hugelius, G., Koven, C.D. , Kuhry, P., Lawrence, D.M., Natali, S.M., Olefeldt, D., Romanovsky, V.E., Schaefer, K., Turetsky, M.R. , Treat, C.C and Vonk, J.E. 2015. Climate change and the permafrost carbon feedback. Nature 520: 171–179. doi: 10.1038/nature14338.
Sebag, D., Disnar, J.R., Guillet, B., Di Giovanni, C., Verrecchia, E.P., Durand, A., 2006. Monitoring organic matter dynamics in soil profiles by “Rock-Eval pyrolysis”: Bulk characterization and quantification of degradation. European Journal of Soil Science 57, 344–355.
Shaw, C.H., Banfield, E. and Kurz, W.A. 2008. Stratifying soils into pedogenically similar categories for modeling forest soil carbon. Can. J. Soil Sci. doi: 10.4141/CJSS07099.
Simpson, A.J., Simpson, M.J., Smith, E. and Kelleher, B.P. 2007. Microbially derived inputs to soil organic matter: Are current estimates too low?. Environ. Sci. Technol. 41: 8070-8076. doi: 10.1021/es071217x.
Simpson, A.J., Simpson, M. J. and Soong, R. 2018. Environmental nuclear magnetic resonance spectroscopy: An overview and a primer. Anal. Chem. 90. doi: 10.1021/acs.analchem.7b03241.
Simpson, M. J. and Simpson, A. J. 2012. The chemical ecology of soil organic matter molecular constituents. J. Chem. Ecol. 38:768–784. doi: 10.1007/s10886-012-0122-x.
Six, J., Conant, R.T., Paul, E.A. and Paustain, K. 2002. Stabilization mechanisms of soil organic matter: Implications for C-saturation of soils. Plant Soil 241: 155-176. doi: 10.1023/A:1016125726789.
Sollins, P., Kramer, M.G., Swanson, C., Lajtha, K., Filley, T., Aufdenkampe, A.K., Wagai, R and Bowden, R.D. 2009. Sequential density fractionation across soils of contrasting mineralogy: evidence for both microbial- and mineral-controlled soil organic matter stabilization. Biogeochemistry 96: 209–231. doi: 10.1007/s10533-009-9359-z.
Soucemarianadin, L. N., Quideau. S.A., Wasylishen, R.E. and Munsen, A.D. 2015. Early-season fires in boreal black spruce forests produce pyrogenic carbon with low intrinsic recalcitrance. Ecology 96: 1575–1585.
Tarnocai, C. 2008. The amount of organic carbon in various soil orders and ecological Provinces in Canada. Pages 81-92 in R., Lal, J.M. Kimble, R.F. Follett and B.A. Stewart, eds. Soil Processes and the Carbon Cycle. CRC Press, Boca Raton, Fla.. doi: 10.1201/9780203739273.
Trumbore, S. E. and Druffel, E. R. M. 1995. Carbon isotopes for characterizing sources and turnover of nonliving organic matter. Pages 7-22 in R.G. Zepp and C. Sonntag, eds. Role of Nonliving Organic Matter in the Earth’s Carbon Cycle. John Wiley& Sons Ltd., Chichester..
VandenBygaart, A. J., Gregorich, e.G., Angers, d.A. and Stoklas, U.F. 2004. Uncertainty analysis of soil organic carbon stock change in Canadian cropland from 1991 to 2001. Glob. Change. Biol. 10: 983-994 doi: 10.1111/j.1365-2486.2004.00780.x.
Walker, X. J., Baltzer, J.L., Cumming, s.g., Day, N.J., Ebert, C., Goetz, S., Johnstone, J.F., Potter, S., Rogers, B.M., Schuur, E.A.G, Turetsky, M.R. and Mack, M.C. 2019. Increasing wildfires threaten historic carbon sink of boreal forest soils. Nature 572: 520-531. doi: 10.1038/s41586-019-1474-y.
Whalen, J.K., Gul, S., Poirier, V., Yanni, S.F., Simpson, M.J., Clemente, J.S., Feng, X., Grayston, S.J., Barker, J., Gregorich, E.G., Angers, D.A., Rochette, P., and Janzen, H.H. 2014. Transforming plant carbon into soil carbon: Process-level controls on carbon sequestration. Can. J. Plant Sci. 94. doi: 10.4141/CJPS2013-145.
Les auteurs
Sylvie Quideau, professeure, Département des ressources renouvelables, Faculté des sciences de l’agriculture, de la vie et de l’environnement, Université de l’Alberta

J’enseigne la biogéochimie des sols. Je porte un intérêt particulier aux flux de carbone et aux processus liés à la matière organique. Mes recherches couvrent trois domaines : 1) quantification des facteurs environnementaux qui sont déterminants pour l’accumulation et la distribution de la matière organique dans les sols ; 2) dévelopement d’indices de qualité de la matière organique directement liés aux fonctions des sols (flux d’éléments nutritifs et biodiversité) ; 3) réponse de la matière organique du sol aux perturbations naturelles et anthropiques.
*
Myrna Simpson, professeure et titulaire de la Chaire de recherche du Canada (niveau 1) en biogéochimie moléculaire intégrative, Département des sciences physiques et environnementales, Université de Toronto

Je suis professeure de chimie environnementale et titulaire d’une chaire de recherche du Canada (niveau 1) en biogéochimie moléculaire intégrative. Je travaille à la mise au point de méthodes de mesures analytiques de la composition de la matière organique du sol. J’utilise ces méthodes dans le cadre de travaux sur la caractérisation des impacts anthropiques sur la composition et la dynamique de la matière organique dans les forêts, le Haut-Arctique et les agroécosystèmes. Je suis également directrice associée du Centre de RMN de l’environnement à l’Université de Toronto Scarborough, la seule installation de RMN à haut champ au Canada consacrée à la recherche environnementale.
*
Adam Gillespie, professeur adjoint, École des sciences de l’environnement, Université de Guelph

Je suis professeur adjoint en biochimie des sols à l’École des sciences de l’environnement. Je cultive un intérêt marqué pour l’application de la recherche et l’innovation en matière d’appareillage à la gestion des terres, à la santé des sols et à leur utilisation durable. Mes recherches vont en ce sens, car elles portent sur la caractérisation de la matière organique à l’aide de méthodes spectroscopiques et thermiques, sur le cycle du carbone et sur la modélisation.
La fraction organique du sol; comprend les résidus végétaux et animaux à divers stades de décomposition, les cellules et les tissus des organismes du sol et les substances synthétisées par la population du sol. Il est généralement déterminé sur un sol qui a traversé un tamis de 2,0 mm.
La décomposition d'un matériau complexe en matériaux plus simples. Le matériau complexe peut être organique ou inorganique, et la chaleur, la lumière du soleil, l'eau, les produits chimiques ou le métabolisme peuvent provoquer la décomposition. La décomposition métabolique est réalisée par des organismes décomposeur.
Détachement et mouvement du sol par l'eau, le vent, la glace et/ou la gravité.
Disposition des particules primaires du sol (sable, limon, argile) autour de la matière organique du sol et par des associations de particules. Particules de sol maintenues dans une seule masse ou un seul amas, comme une motte, une miette, un bloc ou un prisme. La stabilité des agrégats est un bon indicateur de la santé du sol.
(1) La configuration d'une surface, y compris son relief, ou ses élévations relatives, et la position de ses caractéristiques naturelles et artificielles.
(2) L'étude ou la description des caractéristiques physiques de la surface de la Terre.
(3) Les caractéristiques physiques d'un district ou d'une région, telles que représentées sur les cartes, prises collectivement; en particulier le relief et le contour de la terre.
La perturbation des dépôts sédimentaires par les organismes vivants. Par exemple, brassage des horizons du sol par un terrier.
(biochimique) La conversion d'une substance organique en une forme inorganique, souvent à la suite d'une décomposition microbienne. La minéralisation brute est la quantité totale convertie, et la minéralisation nette, la minéralisation brute moins la demande de croissance ou l'immobilisation par les organismes décomposeurs, habituellement mesurée dans les incubations de laboratoire.
Pas cristallin, ou pas apparemment cristallin. Un solide minéral qui n'a pas l'ordre à longue portée caractéristique d'un cristal. L'ordre interne des liaisons chimiques et des atomes est aléatoire ou d'ordre très court. Les grains minéraux individuels sont généralement très petits et ne produisent aucun modèle de diffraction des rayons X ou ceux avec de très larges pics de faible intensité.
Le processus de capture et de stockage du dioxyde de carbone atmosphérique.
Le processus d'accumulation de tourbe conduisant à la formation de tourbières sur des terres précédemment boisées, des prairies ou même des roches nues, en raison de processus climatiques ou autogéniques. Une caractéristique est le développement de conditions anaérobies dues à l'engorgement.
Processus impliqués dans la décomposition et la stabilisation partielle de la matière organique et conduisant à la formation d'humus.
Un processus de formation de sol résultant de la genèse des sols podzoliques; elle implique la translocation de complexes de matière organique Fe et/ou Al de l'horizon A à l'horizon B, ce qui entraîne la concentration de silice dans la couche éluviée.
Un processus de formation du sol, fonctionnant dans de mauvaises conditions de drainage, qui se traduit par la réduction du fer et d'autres éléments et par des couleurs et des marbrures de gris.