Se creuser la tête
6 La biodiversité et l’écologie des sols
Nathan Basiliko; Kari Dunfield; and Mario Tenuta
OBJECTIFS D’APPRENTISSAGE
À la fin de ce chapitre, l’étudiant devrait être en mesure :
- d’énumérer et décrire les principaux groupes d’organismes qui vivent dans les sols, y compris leur taille, leur distribution et le groupe taxonomique auquel ils appartiennent;
- de définir les stratégies métaboliques des organismes du sol en termes de capacité d’absorber l’énergie et les éléments nutritifs de l’environnement;
- de décrire certains des plus importants défis rattachés à l’étude et à la compréhension des organismes du sol, en prenant connaissance des avancées technologiques qui ont permis de surmonter certains de ces défis;
- de décrire le rôle intégrateur que jouent les communautés biologiques dans le renouvellement de la matière organique, le cycle des éléments nutritifs et la fertilité du sol, sujets qui sont traités en détail dans les chapitres 3 et 7;
- de décrire certaines des interactions trophiques importantes entre les différents groupes d’organismes vivant dans les sols.
INTRODUCTION
La communauté mystérieuse sous vos pieds !
Depuis la découverte par Schatz et Waksman en 1943 d’un antibiotique qui sauve des vies, la streptomycine, produite par les bactéries du sol, la biologie du sol est devenue l’une des disciplines scientifiques les plus passionnantes et avant-gardistes. Depuis, les microbiologistes ont découvert de nombreuses autres classes d’antibiotiques produits par des microorganismes du sol. Avez-vous déjà eu une infection bactérienne ou fongique pour laquelle un antibiotique vous a été prescrit ? Remerciez les microorganismes du sol. Cependant, ces découvertes ne représentent qu’une infime partie des communautés biologiques qui font des sols leur habitat. Les sols sont maintenant reconnus comme étant l’habitat le plus riche en biodiversité sur Terre. La nature extrêmement complexe des sols en termes de composition physico-chimique, sujet abordé dans les chapitres 3, 4 et 5, a favorisé la création d’une vaste diversité de milieux propices à l’évolution de millions, voire de milliards de taxa uniques au sol. Or, l’activité biologique des organismes du sol constitue une contribution vitale aux écosystèmes, dont l’homme tire plusieurs services dits écosystémiques : des services d’approvisionnement et de soutien (nourriture, eau de qualité), de régulation climatique (stockage de carbone atmosphérique et échange de gaz à effet de serre) et des bénéfices culturels intangibles.
Matière à réflexion !

Aussi improbable que cela puisse paraître, un pédologue a remporté le prix Nobel de physiologie ou de médecine pour avoir guéri la tuberculose, autrefois l’une des maladies respiratoires les plus dévastatrices au monde. Selman Waksman, ukrainien de naissance, a passé la majeure partie de sa carrière à titre de professeur à l’Université Rutgers du New Jersey (États-Unis). Au début du 20e siècle, il fut l’un des premiers avec un petit groupe à étudier la microbiologie des sols et la matière organique.
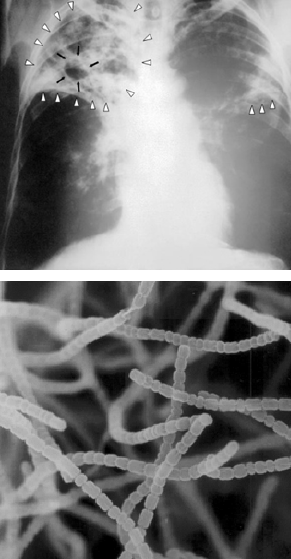
L’équipe voulait en savoir plus sur la nature chimique complexe de l’humus d’un sol (voir le chap. 3), y compris le rôle que pouvaient exercer les microorganismes du sol dans la formation et la décomposition dudit humus. L’équipe de recherche de Waksman s’était particulièrement intéressé aux propriétés physiologiques des champignons et bactéries présentes dans les sols, sachant déjà que certains produisaient de puissants antibiotiques. L’étudiant au doctorat Albert Schatz, supervisé par le professeur Waksman, avait caractérisé la grande collection de cultures de Streptomyces dont les souches provenaient de sols et de composts locaux. Ces bactéries étaient déjà reconnues pour leur capacité à tuer l’agent pathogène Mycobacterium tuberculosis. L’apport de l’étudiant aura été d’éventuellement isoler la streptomycine, le premier antibiotique qui avait effectivement tué l’agent pathogène sans avoir aussi tué le patient ! L’histoire raconte que, selon Schatz, le professeur Waksman avait si peur de travailler avec les cultures de Mycobacterium contre lesquelles aucun remède n’existait à l’époque qu’il ne s’était jamais aventuré dans le laboratoire où Schatz manipulait la bactérie responsable de la tuberculose. Les deux chercheurs ont publié ensemble cette découverte de la streptomycine. La production commerciale de la streptomycine a permis de sauver d’innombrables vies. Cette découverte avait suscité la controverse ; Schatz avait été d’abord exclu de tout paiement de redevances sur les brevets. Le prix Nobel de physiologie ou de médecine de 1952 n’avait été seulement attribué qu’au professeur Waksman. Il avait été jugé que la tâche d’obtenir les cultures de bactéries du sol était plus méritoire que celle, plus routinière, de tester l’effet antibiotique des bactéries.
Ce chapitre présente toute la gamme d’organismes du sol (le biote) — des bactéries unicellulaires et archées d’un diamètre inférieur à 1 micron (c.-à-d. moins de 1/1 000 000 m) à la chenille nocturne (souvent très appréciée, mais aussi parfois détestée), jusqu’à la petite faune vertébrée. Ces organismes ont coevolué et adopté des stratégies de croissance et de survie en fonction de leurs différentes interactions réciproques. Les organismes vivant dans le sol — depuis les microorganismes jusqu’à la petite faune vertébrée – interagissent non seulement entre eux et avec les plantes, mais aussi avec leur environnement physique, qu’ils contribuent à transformer par le fait même (voir chap. 4). Ce chapitre fait entrer en scène tous ces organismes du sol en tant que contributeurs clés du cycle du carbone, de la matière organique (voir chap. 3) et du cycle des éléments nutritifs essentiels aux plantes, comme l’azote (voir chap. 7).
Le contenu du chapitre révélera à quel point l’éventail et la profondeur de nos connaissances sur la biodiversité du sol sont encore très limitées, tout comme le sont nos connaissances sur les fonctions exactes qu’exercent de nombreuses populations et communautés au sein de l’écosystème « sol ». Cette affirmation concerne particulièrement les microorganismes et les microarthropodes du sol. Toutefois, les nouveaux outils de biologie moléculaire qui permettent depuis une décennie de détecter et de caractériser la biodiversité ont déjà permis de dresser un portrait des millions, voire des milliards d’organismes « connus et inconnus » vivant dans les sols. Cela donne un tel essor à l’évolution des connaissances sur la biologie du sol qu’il faudra sans doute réécrire ce chapitre au complet d’ici une dizaine d’années !
BIODIVESITÉ DU SOL
Qui vit dans le sol ?
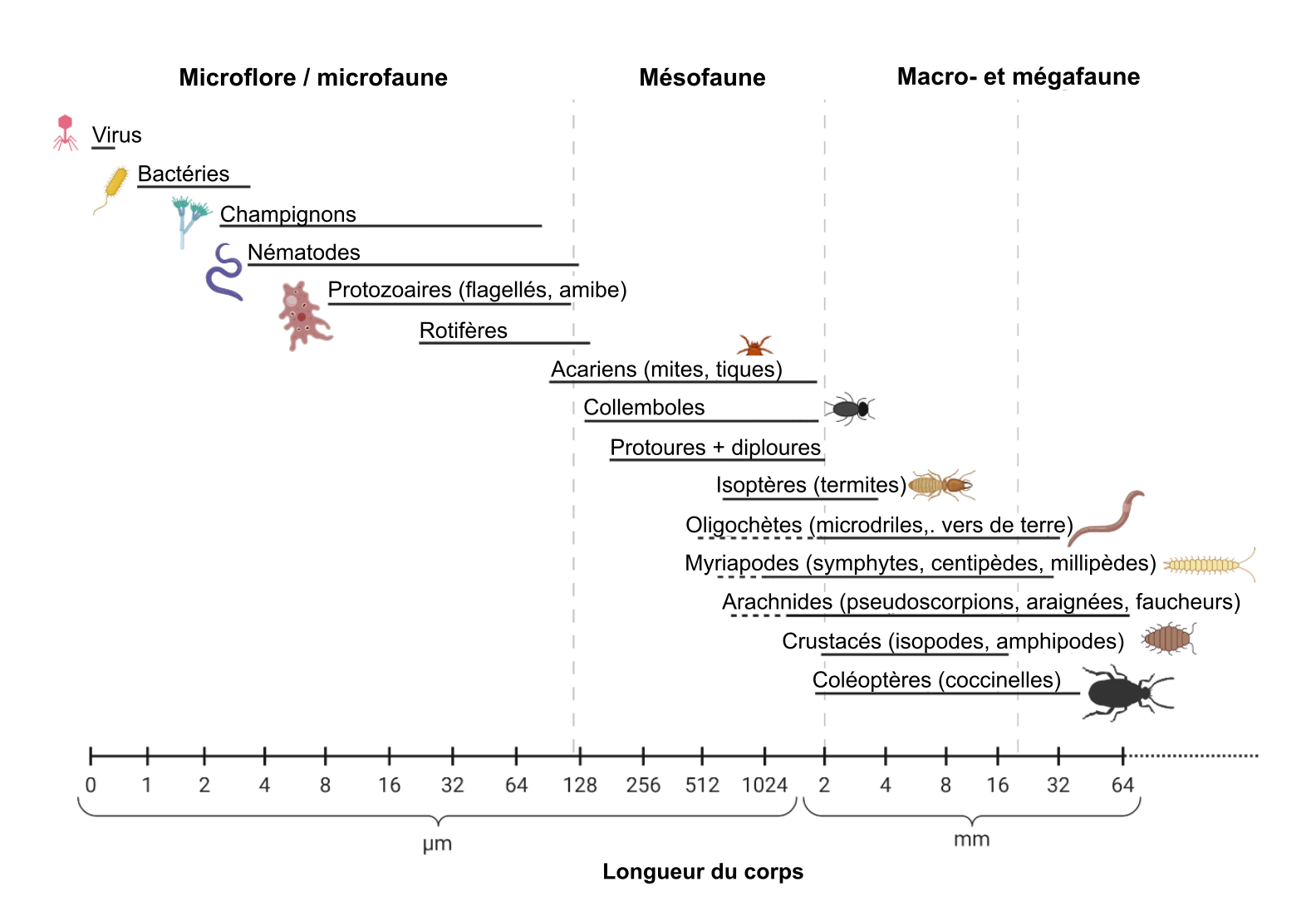
Une simple poignée de sol de surface contient plus d’organismes que l’ensemble de la population humaine sur Terre, avec plus de 10 milliards de cellules dans un seul gramme ! L’étendue des organismes vivants dans le sol va des procaryotes unicellulaires microscopiques aux petits mammifères à sang chaud comme les campagnols et les marmottes, jusqu’à une partie des végétaux (environ la moitié). Ainsi, la gamme de taille des organismes vivant dans l’écosystème « sol » s’étend sur près de dix ordres de grandeur ! Par exemple, la plus petite bactérie du sol mesure environ 0,5 micron de diamètre (0,000 005 m), les amphibiens et les mammifères vivant dans le sol peuvent mesurer 10 centimètres (cm) de longueur (0,1 mètre), les racines des plantes mesurent entre 0,1 et 10 mètres (m) de longueur, tandis que certains champignons pathogènes des sols forestiers produisent des mycéliums filiformes qui s’étendent jusqu’à 1 kilomètre (km) (1000 m) et même plus ! Suivant la tradition, les pédologues ont toujours regroupé le biote du sol en fonction de certaines combinaisons grossières de taille et de fonction (voir fig. 6.1). Bien qu’il soit utile de connaître ces groupes — la terminologie associée est toujours en usage — la présentation des grands groupes d’organismes du sol sera quelque peu différente, à commencer par les procaryotes, qui comprennent les bactéries et les archées. Le terme procaryote définit les organismes unicellulaires dépourvus d’organelles à l’intérieur de leur membrane (par ex., noyau, mitochondrie, chloroplaste), tandis que le terme eucaryote définit les organismes dont les cellules contiennent au moins un noyau et souvent d’autres organelles.
Les pédologues et les écologistes utilisent souvent les groupes suivants pour décrire les organismes du sol :
- Microflore : bactéries, archées (les deux domaines du vivant à cellules procaryotes, c.-à-d. les organismes dépourvus de noyaux et d’autres organelles), algues et champignons
- Macroflore : racines des plantes
- Microfaune: protozoaires (eucaryotes unicellulaires mobiles), petits nématodes et microarthropodes
- Mésofaune : comprends les métazoaires (par allusion au phylum animal) de taille généralement comprise entre 0,1 et 2 mm, et les plus grands nématodes prédateurs et omnivores
- Macrofaune : comprend tous les invertébrés métazoaires de plus de 2 mm étant classé dans le phylum des chordés (mammifères, amphibiens).
Cependant, l’appellation des groupes souffre d’une certaine rigueur.
Par exemple, l’appellation microflore comprend l’idée de « petite plante », mais les algues et les cyanobactéries sont — comme les plantes — photoautotrophes, alors que de nombreuses bactéries du sol et tous les champignons du sol sont hétérotrophes. De plus, bien que certains champignons (levures) soient unicellulaires, d’autres forment de grandes fructifications macroscopiques (voire massives) et des mycéliums (voir fig. 6.2).

Bactéries et archées
Parce qu’elles étaient toutes deux unicellulaires, dépourvues d’organelles et de taille similaire (d’un à quelques microns de diamètre), les bactéries et les archées ont été longtemps classées dans le même groupe jusqu’au début des années 1990 où l’on a pu constater suffisamment de différences entre les deux pour justifier de les diviser en deux groupes. Ces différences traduisent la divergence qui s’est produite dans leur évolution respective (il y a de ça très longtemps). Cette divergence s’illustre notamment par des différences d’enveloppe cellulaire (membrane, paroi et autres couches externes), de mécanisme de synthèse de protéines, de compaction de l’ADN et autres différences majeures de nature physiologique. En fait, les différences trouvées entre les bactéries et les archées à partir d’analyses de séquences d’ADN sont aussi marquées que celles qui existent entre les plantes et les animaux supérieurs. Carl Woese de l’Université de l’Illinois (États-Unis) est le principal chercheur derrière le premier remaniement majeur de l’arbre phylogénétique (montrant les relations de parenté entre les groupes d’êtres vivants) qui a été effectué à partir des séquences d’ADN. Il avait d’ailleurs proposé de fonder l’évolution des formes de vie sur seulement trois branches principales (domaines) : les bactéries, les archées et les eucaryotes. Malgré les différences fondamentales qui existent entre les bactéries et les archées, tel qu’il a été mentionné ci-dessus, elles sont tout de même toutes deux des organismes microscopiques qui interagissent dans les micro-habitats que sont les particules de sol et elles ont toutes deux la capacité d’évoluer rapidement vers de nouveaux environnements, conditions et ressources, grâce à leur mécanisme commun de transfert horizontal de gènes. Cela signifie qu’elles peuvent partager les mêmes niches dans les environnements pédologiques, de même que toute une gamme de stratégies métaboliques (tableau 6.1), notamment :
- le recours à la source d’énergie ATP
- le recours à des molécules qui fournissent des électrons à la chaîne de transport d’électrons à dessein de produire de l’énergie métabolique sous forme d’ATP
- le recours au carbone dans la synthèse de nouvelles molécules organiques.
Les bactéries prédominent sur les archées en nombre et en biomasse dans le sol en surface. Cependant, les archées chimiolithotrophes font exception. Elles produisent dans le sol en surface (1) des réactions très spécifiques d’oxydation de l’ammoniac (voir chap. 7) au cours du cycle de l’azote ou (2) du méthane qui émane des sols inondés privés d’oxygène. Le rôle de plusieurs autres archées du sol n’est pas encore bien connu. La stratégie qui consiste à obtenir de l’énergie (des électrons) à partir de l’environnement par lithotrophie signifie littéralement « qui mange de la matière minérale » (voir tableau 6.1).
Tableau 6.1 Stratégies d’acquisition d’énergie du biote du sol pour la synthèse d’ATP et de la mobilisation du carbone à des fins de production de biomasse et termes courants associés (tous se terminant par « -trophe » signifiant grossièrement « nourriture »). Il est à noter que seules certaines bactéries et archées sont des chimiolithotrophes ; elles soutirent les électrons des composés minéraux réduits grâce auxquels elles produisent des réactions d’oxydo-réduction et synthétisent de l’ATP.
| Source d’énergie/électrons | Source de carbone pour la synthèse des biomolécules | Appellation |
|---|---|---|
| Recours à l’énergie solaire pour diviser H2O | CO2(le carbone inorganique est chimiquement réduit ou « fixé » en carbone organique) | photoautotrophe (phototrophe) |
| Composés minéraux réduits (c.-à-d. non organiques) | CO2 (le carbone inorganique est fixé dans des formes organiques par le recours au cycle de Calvin ou par d’autres voies d’assimilation | chimiolithoautotrophe |
| Composés minéraux réduits | Matière organique | chimiolithohétérotrophe |
| Matière organique | Matière organique | chimioorganohétérotrophe (hétérotrophes) |
De nombreuses bactéries du sol sont hétérotrophes (voir tableau 6.1). La plupart d’entre elles utilisent des molécules de carbone organique qui intègrent l’écosystème du sol principalement sous forme de litière végétale ou de racines de plantes et qui sont déjà dans un état chimiquement réduit (c.-à-d. que le carbone est sous forme réduite comme dans les molécules organiques, par opposition au dioxyde de carbone). Les cyanobactéries couramment retrouvées dans les habitats marins et aquatiques peuvent également habiter la surface des sols humides exposée à la lumière du soleil. Les cyanobactéries sont également connues pour vivre en symbiose et d’entretenir des relations mutualistes avec un certain nombre d’espèces végétales. Certains lichens à la surface du sol contiennent également des cyanobactéries comme symbiote photosynthétique. Contrairement aux organismes eucaryotes, une bonne proportion des bactéries du sol et certaines archées ont la capacité d’effectuer la respiration cellulaire en l’absence d’oxygène moléculaire (O2), utilisant plutôt des formes oxydées d’autres éléments comme l’azote (N), le soufre (S), le manganèse (Mn) et le fer (Fe) comme accepteur d’électrons dans la production d’ATP (la principale source d’énergie dans les cellules). Ces moyens de respiration anaérobie génèrent souvent relativement plus d’ATP par rapport à ce que génèrent certains eucaryotes, comme les levures, qui produisent des réactions de fermentation en cas de manque d’O2, en plus d’influencer considérablement le bilan des éléments nutritifs dans le sol. En raison de leur petite taille, les bactéries et les archées peuvent résider dans des pores du sol aussi petits que 1 micron de diamètre. Beaucoup sont attachées à la matrice du sol, mais certaines restent mobiles, se déplaçant autour et entre les particules sur les films d’eau.
Champignons
Les champignons du sol des catégories « levures unicellulaires » et « moisissures filamenteuses multicellulaires » sont des hétérotrophes, plus spécifiquement des chimioorganotrophes eucaryotes (voir tableau 6.1). Ils jouent un rôle très important dans la décomposition de plantes ligneuses et d’autres plantes riches en cellulose et en lignine, qui constituent des litières pauvres en éléments nutritifs tels que l’azote (voir chap. 3). Ainsi, dans les sols forestiers, ces champignons ont tendance à dominer les processus de décomposition par rapport aux bactéries, qui peuvent toutefois dominer dans les sols alcalins ou à des valeurs de pH qui se rapprochent de la neutralité. Champignons et bactéries sont souvent tous deux considérés comme les principaux microorganismes décomposeurs hétérotrophes dans les sols. Bien que dans un sol le nombre de cellules fongiques soit inférieur au nombre des cellules bactériennes, la taille des premières est d’environ dix fois plus grandes que la taille des secondes. Toutefois, dans les sols légèrement acides, les deux classes de microorganismes décomposent la matière organique au même rythme. Si les champignons sont plus tolérants à la sécheresse (teneur en eau (θ) ; chap. 4) que les bactéries, ces dernières sont en revanche plus tolérantes au manque d’oxygène (conditions dites anoxiques ou anaérobies).
Certains champignons, appelés champignons mycorhiziens, vivent en symbiose avec la plupart des espèces végétales (le terme mycorhize désigne l’association champignon/plante hôte). Des champignons mycorhiziens spécifiques colonisent des racines d’espèces végétales spécifiques ; les hyphes filamenteux s’étendent en réseau (les structures macroscopiques formées par les hyphes sont appelées mycélium). Au premier coup d’œil, le mycélium peut ressembler aux racines de la plante elle-même (fig. 6.3). Habituellement, l’association mycorhizienne est de nature mutualiste ; la plante fournit les sucres au champignon qui les utilise comme source d’énergie. Le champignon le lui rend bien, car il aide la plante 1) à lui fournir ses éléments nutritifs en les faisant transiter à travers l’étendue de son réseau d’hyphes, 2) à se protéger des parasites ou des agents pathogènes potentiels grâce aux composés antibiotiques qu’il sécrète, et 3) à structurer la rhizosphère en facilitant dépolarisation des protéines (ex. : minéralisation de l’azote) et la production de composés polysaccharidiques tels que la glomaline. Deux importants types d’associations mycorhiziennes se distinguent : les ectomychorizes où le champignon entoure les couches externes des cellules des racines des plantes et les mycorhizes arbusculaires qui forment des symbiotes obligatoires aux plantes (c.-à-d. que le champignon ne peut pas croître sans leur plante hôte) et qui s’étendent à l’intérieur des parois cellulaires du cortex racinaire (fig. 6.3). Les réseaux mycéliens mycorhiziens peuvent être omniprésents dans le sol ; le mycélium peut même former des associations mycorhiziennes avec des racines appartenant à plus d’une espèce de plantes, permettant à ces dernières de partager du carbone et des éléments nutritifs (par ex. azote et phosphore) à travers le réseau mycélien qui les relie toutes par les racines. Une sorte d’internet du sol.

Les champignons du sol ont des cycles de vie variables. Les levures demeurent des organismes unicellulaires, mais peuvent exister sous diverses formes (1 n) haploïdes ou (2 n) diploïdes et se diviser par mitose dans le cas des deux formes selon différentes situations. La forme 1n caractérise l’état principal des champignons. Ils prennent la forme 2n dans trois situations : lors de la reproduction sexuée (combinaison génétique) ; lorsque les conditions sont mauvaises (p ex. un stress hydrique) ; lors de rareté de ressources, comme le manque de matières végétales facilement décomposables. L’avènement de variations génétiques pourrait leur permettre de mieux faire face au stress. L’état 2n entreprend alors une méiose pour ramener le champignon à l’état haploïde 1n. Les étapes du cycle de vie des moisissures filamenteuses multicellulaires peuvent inclure des phases de fructification (champignons, boules) et des phases de spores unicellulaires. Cependant, la croissance des champignons se produit en majorité par division mitotique de l’état haploïde 1n. Certains champignons sont des saprophytes (qui dégradent la matière organique du sol et les matières végétales mortes) ou des pathogènes des plantes (qui leur causent des maladies). Certaines des maladies les plus dévastatrices des plantes sont causées par des champignons, tels que la rouille des céréales et des graminées et l’armillaire couleur de miel causant la pourriture blanche de nombreuses espèces d’arbres feuillus et de conifères. La largeur des hyphes fongiques indique qu’ils peuvent occuper les pores du sol de 5 microns de diamètre et plus.
Moisissures aquatiques
Les moisissures aquatiques, également appelées « oomycètes », sont des eucaryotes multicellulaires filamenteux (formant des hyphes), qui sont davantage liés au varech géant des océans qu’aux champignons ! Elles sont nommées moisissures aquatiques, car elles préfèrent vivre dans l’eau ou dans un sol saturé d’eau. Comme elles ont des hyphes, elles sont souvent confondues avec les champignons. L’état normal des moisissures aquatiques est diploïde (2n). Elles peuvent se reproduire de manière asexuée (sans combinaison génétique) par mitose ; cela produit des zoospores mobiles 2n qui germent puis forment des hyphes. Les zoospores ont besoin de pores remplis d’eau pour se déplacer avec leurs flagelles. La reproduction sexuée se produit par combinaison génétique d’un filament d’hyphe n mâle avec un filament d’hyphe femelle qui est suivie d’une méiose, laquelle génère une oospore 2n non mobile. Les parois très épaisses dont sont dotées les oospores leur permettent de demeurer dans le sol pendant des années et de résister au stress causé par l’assèchement et le gel. Dans des conditions humides et riches en ressources (p. ex. forte densité de coiffes racinaires des plantules), les oospores germent et produisent de nombreuses zoospores 2n mobiles. Les espèces d’oomycètes peuvent être des saprophytes ou des phytopathogènes. Les pathogènes des plantes peuvent être extrêmement nuisibles, comme le pathogène du mildiou de la pomme de terre, qui a contribué à causer la famine de 1845-1849 en Irlande et la pourriture des racines à légumineuses Aphanomyces, qui cause actuellement la mort subite des chênes en Californie. La largeur des hyphes des moisissures aquatiques indique qu’elles peuvent occuper les pores du sol de 5 microns de diamètre et plus.
Algues vertes
Les algues sont des organismes photosynthétiques non végétaux (on dit aussi « photoautotrophes » ; voir tableau 6.1) dont les cellules contiennent des organelles (c.-à-d. qu’elles sont des eucaryotes). Ce sont des producteurs de biomasse primaires très importants dans les écosystèmes aquatiques (p. ex. les lacs) et dans les habitats aquatiques et marins. Le type d’algues vertes va des algues unicellulaires aux grandes algues. Les algues unicellulaires se trouvent principalement dans les zones humides à la surface de certains sols où elles captent la lumière du soleil, mais elles demeurent peu abondantes. Généralement, dans l’apport de carbone fixé par photosynthèse fourni par les écosystèmes terrestres, celui des algues compte très peu par rapport à celui des plantes. Les algues vertes croissent sur la surface des sols humides et dans des pores de plus de 50 microns de diamètre remplis d’eau.
Une exception importante à cette règle concerne les lichens ; ces derniers peuvent autant coloniser les petits amas de matière organique, les affleurements rocheux, les surfaces nues du sol et des parties de plantes ligneuses sur pied ou tombées. Les lichens sont des cas intéressants où deux espèces s’unissent pour former une « espèce » entièrement nouvelle. Les lichens représentent une importante symbiose mutualiste (c.-à-d. différents organismes vivant ensemble) ; ils possèdent à la fois un « photobionte » et un « mycobionte ». Dans environ 90 % des « espèces » de lichens, le photobionte est une algue, tandis que le mycobionte est toujours un champignon. Dans cette relation mutualiste, le photobionte fixe le CO2 par photosynthèse, tandis que le partenaire fongique fournit la plus grande partie de la forme et de la structure. En plus de fournir l’ancrage physique qui maintient le lichen en place, les champignons dans l’association lichen/algue (chimioorganohétérotrophes ; tableau 6.1) transmettent également l’eau et les éléments nutritifs essentiels de l’environnement (p. ex. l’azote, le phosphore) aux cellules de l’algue qui assurent la photosynthèse. Dans environ 10 % des lichens, les photobiontes sont des bactéries photosynthétiques appelées « cyanobactéries ». Récemment, il a été observé que certains lichens formaient une symbiose tripartite entre une algue, une cyanobactérie et un champignon. Les lichens ont la capacité de vivre dans des environnements très difficiles, ce qui en fait d’importants colonisateurs primaires de sols stériles et même de roches (fig. 6.4). Certains lichens en symbiose avec une cyanobactérie ont également la capacité de fixer l’azote gazeux atmosphérique sous forme d’ammoniac — qui est rendu utilisable par le partenaire fongique, ce qui constitue un apport d’azote pour les plantes. Les lichens remplissent d’importants rôles écologiques à titre de colonisateurs : (1) en couvrant les sols exposés et les régosols (nouveaux sols chap. 8) ce qui empêche leur érosion, (2) en fabriquant du sol par leur apport de matière organique et d’azote qu’ils ont rendu disponible aux plantes et (3) en contribuant à amorcer la succession végétale sur le sol minéral par la production d’acides organiques, acides capables d’altérer les minéraux, les rendant ainsi disponibles pour d’autres végétaux.

Protozoaires
Les protozoaires sont des microorganismes unicellulaires eucaryotes (ils ont un noyau et souvent d’autres organelles) hétérotrophes (ils se nourrissent de la matière organique ; voir tableau 6.1) qui peuvent se déplacer dans l’eau (ils sont mobiles). Bien qu’il soit de taille variable, un protozoaire typique peut être dix fois plus gros qu’une bactérie, mais demeure quand même microscopique. Les protozoaires se distinguent selon la façon dont ils se déplacent ; les amibes déplacent leur cytosquelette et avancent grâce à leurs pseudopodes ; les ciliés comme la paramécie se déplacent par mouvement ondulatoire de leurs cils ; les flagellés utilisent l’un ou plusieurs de leurs longs flagelles en forme de fouet pour se déplacer. Bien qu’il reste beaucoup à apprendre sur la diversité des protozoaires et leurs rôles dans le sol, il est connu que beaucoup se nourrissent de bactéries, parfois de champignons. Ce rôle de prédateur les fait participer à (1) la structuration des communautés microbiennes, (2) la minéralisation du carbone (chap. 3), et (3) la minéralisation des éléments nutritifs tels que l’azote et le phosphore (chap. 7) provenant des microorganismes qu’ils auront broutés ou provenant de petites particules de matière organique du sol. Les protozoaires se trouvent généralement en plus grand nombre dans la rhizosphère, là où la matière organique et les bactéries sont abondantes par rapport aux zones du sol où il n’y a pas de racines. Dans le sol, les populations de protozoaires varient en fonction des populations bactériennes ; les premières augmenteront si les populations des deuxièmes augmentent aussi, par exemple après réhumidification du sol ou ajout de fumier animal au sol. En tant qu’organismes nageurs, par définition, les protozoaires résident généralement dans les films d’eau sur les particules du sol et dans les interstices remplis d’eau ; les sols plus secs ne sont pas leur habitat préférentiel. Ils résident aussi dans les pores remplis d’eau de plus de 50 microns de diamètre.
Nématodes
Les nématodes sont des vers ronds eucaryotes multicellulaires non segmentés. Ils constituent jusqu’à 90 % du nombre d’animaux multicellulaires dans le sol, nombre qui a souvent été estimé à plusieurs millions par m2 d’horizon A du sol (voir chap. 2) ! Ce ne sont pas des vers semblables aux vers de terre, qui eux sont des vers segmentés. Ce groupe d’organismes possède ses propres caractéristiques. Les nématodes varient en longueur de 0,5 à 5 mm selon l’espèce. Les nématodes sont longs et étroits avec des extrémités effilées ou arrondies (tête et queue). En comparant les nématodes avec les microorganismes présentés jusqu’ici, on se rend compte du degré avancé de spécialisation de leurs organes. Ils sont dotés d’un système digestif élaboré comprenant une bouche, un œsophage, un tube digestif, un anus pour l’élimination des déchets, un système glandulaire comprenant des ouvertures pour l’osmorégulation avec l’eau du sol, un système reproducteur mâle ou femelle, un système sensoriel chimique et tactile composé d’ouvertures et de diverses structures, un système nerveux et un cerveau rudimentaire. Les nématodes se déplacent en passant par les pores du sol remplis ou presque remplis d’eau, de plus de 50 microns de diamètre.
Matière à réflexion !
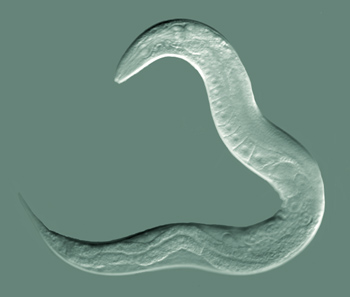
Les nématodes sont des animaux très robustes et fascinants. Le nématode le plus connu est le Caenorhabditis elegans. On pense qu’il a été collecté pour la première fois en Angleterre dans un tas de fumier animal. Ce nématode présent dans les sols tempérés humides et riches en résidus végétaux se nourrit de bactéries. La plupart des individus de C. elegans sont des vers hermaphrodites, c.-à-d. des femelles autofertiles. Ils peuvent revenir à la vie même après avoir séchés ou gelés pendant des décennies. Ce petit animal a fait partie de nombreuses missions dans l’espace de la NASA ; il a été le premier organisme multicellulaire duquel on a séquencé le génome, caractérisé le développement cellulaire de l’œuf à l’adulte et cartographié l’ensemble des cellules nerveuses. C. elegans, ainsi nommé par les scientifiques, a fait l’objet de nombreuses percées dans l’histoire récente de la science, notamment des recherches qui ont été récompensées par trois prix Nobel en 2002 et 2006 en physiologie ou médecine et en 2008 en chimie.
Les espèces de nématodes peuvent être assignées à des groupes trophiques spécifiques selon leur préférence alimentaire : végétale, bactérienne, fongique, algale, omnivore ou prédatrice (fig. 6.5). Les nématodes qui se nourrissent de plantes sont des herbivores ; bien que la plupart ne causent pas de dommages aux cultures, certains peuvent être problématiques tels que le nématode à kyste du soja, le nématode à galles de la tomate et le nématode doré de la pomme de terre. Les nématodes omnivores peuvent se nourrir d’hyphes fongiques, de racines fines et de poils absorbants, d’autres nématodes et de mésofaune. Les nématodes prédateurs se nourrissent d’autres nématodes et de la mésofaune.
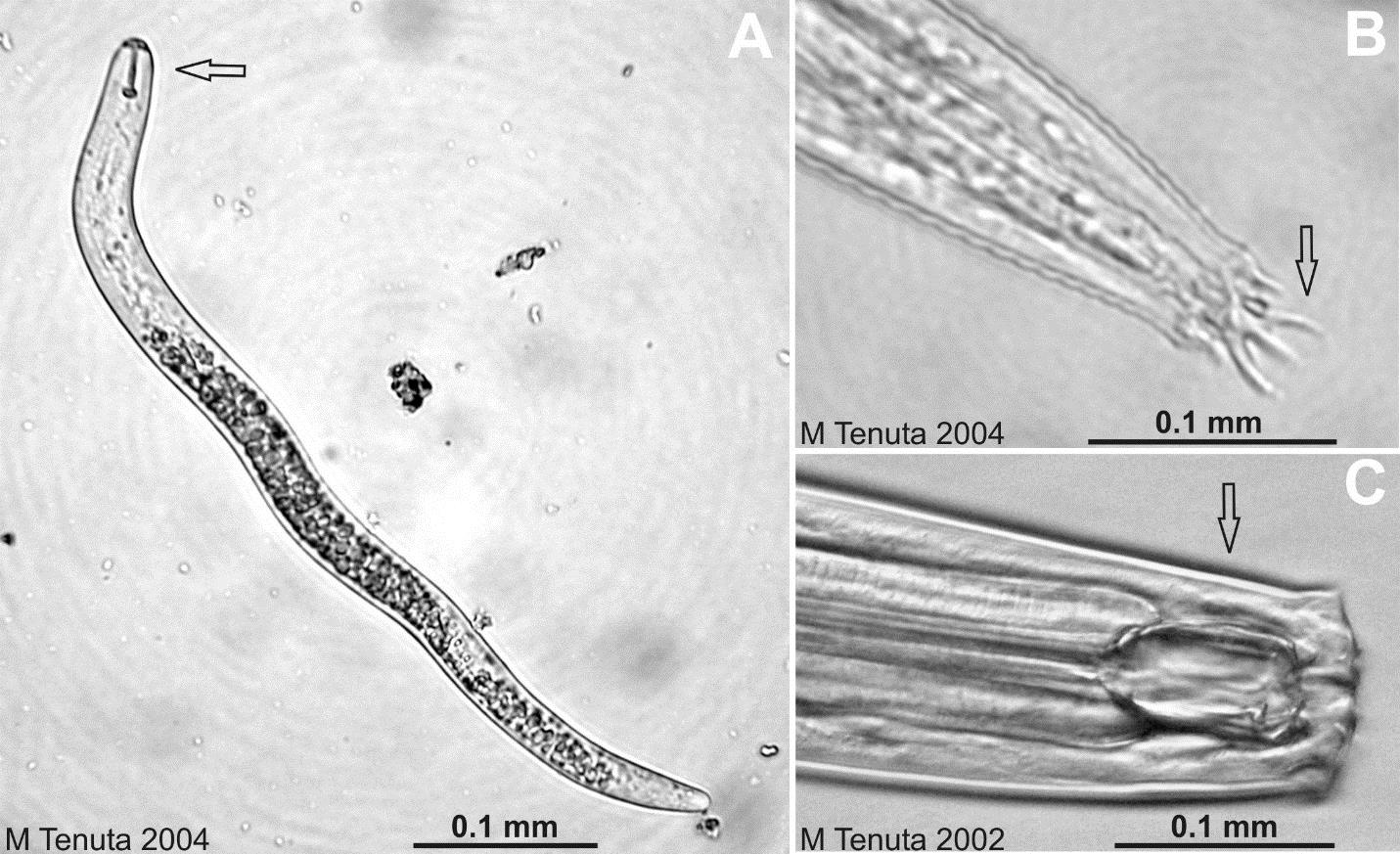
Les nématodes sont d’excellents bio-indicateurs de l’effet des pratiques de gestion sur la santé des sols, car les populations d’espèces en présence sont très sensibles à toute modification des sources de nourriture dans le réseau trophique du sol. C’est pourquoi les populations seront très affectées par l’ajout de pesticides, les rotations, les variations d’humidité et par la présence fortuite de contaminants, comme des métaux. De nombreux nématodes sont des parasites des plantes. Certains nématodes suivent la stratégie r, c.-à-d. la stratégie de croissance et colonisation rapide. En effet, les populations de ces nématodes réagissent très rapidement à la quantité de ressources alimentaires pour lesquelles elles ont une préférence (p. ex. les bactéries) et aux conditions du sol (p. ex. l’humidité et la température). D’autres suivent la stratégie k, c.-à-d. qu’ils prospèrent dans des sols soumis à peu de stress et de conditions peu fluctuantes ; ils ont une croissance lente et une longue durée de vie pour un nématode (d’une à plusieurs années). Enfin, il existe des nématodes intermédiaires, à stratégies r et K ; qui sont les plus abondants dans le sol.
Microarthropodes
Les arthropodes ont des exosquelettes, des pattes appariées et des appendices articulés (p. ex. insectes et araignées). Les sols sont souvent dominés par deux groupes de microarthropodes : les collemboles (de la sous-classe Collembola, qui est souvent utilisée comme nom scientifique) et les acariens (fig. 6.6). Par leur taille (de ~0,1 à 2 mm), les collemboles et les acariens se classent dans la catégorie de la « mésofaune » du sol (voir fig. 6.1). Ils se trouvent dans les sols partout dans le monde, d’ailleurs comme tous les autres groupes d’organismes décrits ci-dessus. En règle générale, on trouve entre 10 et 100 espèces de microarthropodes dans un profil de sol d’un m2 (où jusqu’à 10 000 individus peuvent cohabiter) et sur la végétation en décomposition au-dessus du sol. Les microarthropodes du sol remplissent des fonctions importantes par leurs activités d’alimentation en tant que fongivores (en se nourrissant de champignons), herbivores (p. ex. en se nourrissant de racines fines des plantes), détritivores (en se nourrissant de matière organique et de litière) ou de prédateurs (en se nourrissant d’autres microarthropodes). Certaines espèces de microarthropodes ont des comportements alimentaires hautement spécialisés comme ceux de protozoaires et de nématodes (p. ex. il y a des spécialistes qui broutent des types très spécifiques d’hyphes fongiques). D’autres en revanche, présentent des comportements alimentaires de généralistes herbivores et décomposeurs. Les microarthropodes peuvent exercer une influence sélective sur la structure de la communauté biologique du sol (par ex. en se nourrissant de certains champignons ou d’autres arthropodes), ou en répartissant des cellules microbiennes grâce leur déplacement dans le sol et même améliorer la structure du sol par les agrégats formés par leur matière fécale et par leur activité de creusage (voir chap. 4). Les microarthropodes peuvent se reproduire de manière sexuée ou asexuée. Les collemboles sont généralement considérés comme les premiers colonisateurs des sols récemment perturbés (stratèges r), tandis que les oribates, du fait de leur préférence pour les écosystèmes plus évolués et stables, font d’eux des colonisateurs secondaires (stratégie K).
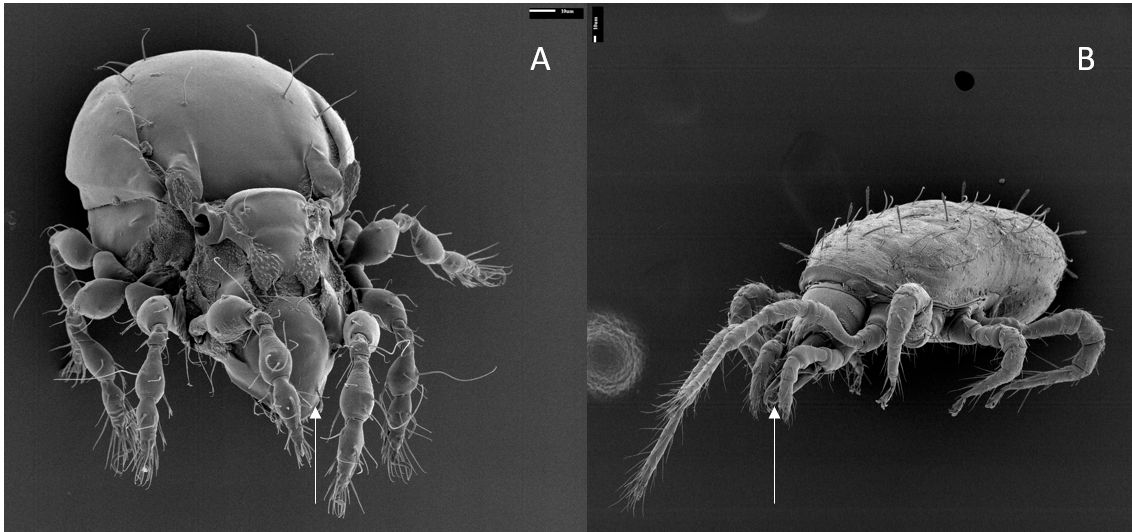
Autres invertébrés
Les sols et leur litière végétale associée abritent également une très grande diversité d’autres grands arthropodes (fourmis, coléoptères et autres) se déclinant en autant de détritivores généralistes et spécialistes, fongivores, herbivores et même carnivores (p. ex. les mille-pattes, ou diplopodes. Les annélides (vers, nom scientifique : Oligochaeta) sont également d’importants invertébrés macroscopiques trouvés dans les sols, dont de nombreuses espèces de vers de terre. Les vers de terre sont souvent vénérés par les agriculteurs et les jardiniers comme étant à la fois des indicateurs de sol sain et des contributeurs à la santé des sols, mais ce paradigme sur les vers de terre ne dit pas tout (fig. 6.7). D’un côté, les vers de terre, notamment le lombric commun (Lumbricus terrestris), créent des trous profonds et excrètent des turricules qui peuvent améliorer la structure du sol, augmenter l’espace poreux dans les sols compactés et accélérer le renouvellement des éléments nutritifs provenant des litières végétales. Les vers de terre sont sans doute utiles dans les écosystèmes à gestion intensive avec travail du sol répété, récolte et gestion des résidus organiques (p. ex. tiges des cultures, fumier de bétail). D’un autre côté, les vers de terre font plus de mal que de bien dans les écosystèmes non gérés ou gérés de manière moins intensive comme les forêts tempérées et boréales. Il existe très peu d’espèces de vers de terre indigènes au Canada ; les exceptions se situent sur l’île de Vancouver et au Yukon. Cela est attribuable au fait que le Canada était presque entièrement couvert de glace (97 %) au cours du dernier maximum glaciaire de l’époque du pléistocène (se terminant il y a environ 12 000 ans) et les vers de terre ne se sont probablement répandus qu’à la suite de la prolifération de l’exploitation des ressources par les colons européens qui ont déplacé du sol avec leur équipement de labour et la gestion inadéquate des vers comme appâts de pêche. En particulier dans les écosystèmes forestiers, l’invasion de vers de terre — par L. terrestris entre autres — a modifié la structure du sol, notamment en éliminant en grande partie la couche d’humus en surface qui constitue un habitat important pour les semis des plantes, les réseaux fongiques et la faune, y compris certains oiseaux qui nichent sur l’humus. De plus, le taux de rétention des éléments nutritifs dans les écosystèmes forestiers matures est particulièrement élevé ; les vieux arbres à croissance lente, produisant principalement de la biomasse ligneuse, n’ont besoin que de petites quantités d’éléments nutritifs comme l’azote et le phosphore pour croître chaque année, quantités qui proviennent en grande partie de la lente décomposition de la matière organique dans les sols forestiers (voir chap. 7). L’invasion par les vers de terre conduit à une stimulation très grande de l’activité des organismes décomposeurs microbiens et à la libération d’un stock d’éléments nutritifs à un rythme trop rapide pour que les arbres puissent les emmagasiner. Il n’est pas surprenant que les vers de terre comme L. terrestris aient reçu le titre « d’ingénieur des écosystèmes » à côté des castors, étant donné l’ampleur des changements qu’ils produisent dans les sols. Par exemple, Charles Darwin a estimé que les vers de terre dans un sol de prairie en Angleterre avaient transporté 5 cm de sol depuis les profondeurs jusqu’à sa surface en dix ans !

Vertébrés
La biomasse des vertébrés dans les sols est assez faible par rapport aux organismes plus petits. Cependant, ils peuvent exercer une influence importante sur le fonctionnement de l’écosystème en modifiant les propriétés physiques et chimiques du sol (par le creusage de tunnels, le mélange des horizons et l’apport de leurs excréments) et en se nourrissant de façon spécialisée ou indistincte du biote du sol. Une gamme de mammifères (spermophile, chien de prairie, marmotte, etc.), d’amphibiens (p. ex. salamandres) et de reptiles (scinques, lézards, tortues, etc.) passent au moins une partie de leur cycle de vie dans des terriers ou sous la litière à la surface du sol. Même des espèces d’oiseaux comme la paruline couronnée passent une partie de leur vie à nicher sur les sols forestiers de l’Est du Canada jusqu’au Centre-Nord des États-Unis. Certains vertébrés comme la salamandre à dos rouge sont des indicateurs utiles de perturbations physiques du sol (labour, activités liées à la foresterie) et chimiques (par ex. pollution) parce que (1) ils ont besoin de vivre dans un habitat stable et de pouvoir compter sur un approvisionnement en nourriture continu, cette dernière étant ordinairement constituée d’une communauté robuste d’arthropodes et (2) ils respirent par la peau.
Virus
Les virus sont même plus petits que les bactéries (de 0,05 à 0,2 micron), ne sont pas des organismes comme tels et ne sont pas « vivants » dans le sens reconnu du terme. Cependant, même s’ils ne sont pas des organismes cellulaires, ils sont composés de biomolécules. Les rôles qu’ils jouent dans l’avènement de maladies et dans l’hérédité sont indéniables dans la plupart, sinon la totalité des organismes et des écosystèmes. Les virus les plus simples sont constitués de matériel génétique (ADN ou ARN) unique et d’une enveloppe protéique appelée capside. Les particules virales dépendent entièrement de leurs hôtes — elles « détournent » le génome de l’hôte avec leur code génétique et ordonnent à la machinerie métabolique de l’hôte (c.-à-d. les ribosomes pour la synthèse des protéines et les ADN ou ARN synthases pour la synthèse des acides nucléiques) de construire des dizaines à des centaines de nouvelles particules virales. Cela conduit inévitablement à la mort des cellules et éventuellement la mort des hôtes dans le cas des organismes unicellulaires comme les bactéries ou les protozoaires. Les virus qui infectent les microorganismes sont également appelés phages ; on les regroupe généralement en fonction du type d’organisme qu’ils infectent (p ex. bactériophage pour les bactéries, mycovirus pour les champignons). Les organismes du sol servent de vecteur à certains virus. Par exemple, certains nématodes herbivores se trouvent à infecter les plantes en s’en nourrissant avec les phytovirus qu’ils « hébergent » dans leur œsophage. L’importance écologique des virus dans le sol est encore mal connue. Cependant, comme les virus sont souvent spécifiques à une espèce d’organisme, ils peuvent présenter autant de diversité que n’importe quel autre groupe d’organismes.
Les sols peuvent servir de réservoir de virus végétaux et animaux qui causent des maladies. Cependant, le rôle des virus dans le fonctionnement de l’écosystème est beaucoup moins clair. Le nombre de particules virales par gramme de sol dans l’horizon de surface peut atteindre un milliard. Cela correspond aux concentrations observées dans les eaux de surface des écosystèmes aquatiques — et depuis les deux dernières décennies le rôle des virus dans le fonctionnement des écosystèmes aquatiques est mieux compris. Les virus sont responsables de la formation des communautés biotiques et de la libération d’un quart de tout le carbone fixé dans la biomasse à partir du CO2 lors de la photosynthèse, en causant la lyse (c.-à-d. qui défait des liaisons) du phytoplancton (cyanobactéries et algues unicellulaires, les principaux producteurs des écosystèmes aquatiques) et des bactéries hétérotrophes. Les virus jouent aussi un rôle similaire dans les sols, mais sur beaucoup plus d’espèces (plus grande richesse) et beaucoup plus de régularité d’espèces (c.-à-d. sans dominance d’un ou de quelques taxons) dans ceux-ci que dans les eaux. Les virus du sol ont très probablement leur façon propre de façonner les communautés biologiques et de participer au fonctionnement des écosystèmes.
Racines des plantes
Les racines font partie du vivant dans le sol, car elles exercent une influence sur le développement et les propriétés du sol autant que n’importe quel autre groupe d’organismes que nous avons présenté dans ce chapitre. La biomasse des racines dans un sol végétalisé est souvent plus élevée que la biomasse formée par tous les autres organismes du sol réunis. Par exemple, un sol couvert de graminées vivaces peut généralement contenir de 10 à 90 t ha-1 de biomasse comparativement à la biomasse produite par les champignons (de 2 à 5) et les bactéries (de 1 à 2) et jusqu’à 2,5, 0,5 et 0,2 t ha-1 concernant la biomasse respective des vers de terre, protozoaires et nématodes. La taille des racines varie et avec elle les pores du sol ce qui signifie plus de facilité d’accès aux éléments nutritifs et à l’eau. Les poils absorbants mesurent environ 10 microns de diamètre, les racines fines jusqu’à 1 mm et les racines grossières plus de 1 mm de diamètre.
Les racines des plantes sont très importantes dans l’écologie des sols. Elles constituent une source majeure de carbone organique, donc d’énergie pour les organismes hétérotrophes et saprotrophes du sol ; elles abaissent les taux d’humidité et d’éléments nutritifs du sol ; elles consomment de l’oxygène par la respiration ; elles modifient les propriétés chimiques (p. ex. le pH du sol) et physiques (p. ex. elles favorisent l’agrégation et la formation de macropores). Les chapitre 3, chapitre 4, et chapitre 5 contiennent plus d’information sur les propriétés chimique et physique des sols.
Répartition des organismes vivants dans le sol
Où réside la majeure partie des organismes dans les profils de sol ? La réponse se trouve en « suivant le carbone ». En effet, étant donné que la plupart des communautés non végétales des sols sont hétérotrophes (voir tableau 6.1) et qu’elles dépendent de la matière organique comme source de carbone et d’électrons pour générer de l’ATP ou de l’énergie, il apparait que la plupart des types de biotes du sol présentés ci-dessus occuperaient la partie la plus en surface du sol, soit dans la rhizosphère (zone de concentration des racines) et dans l’horizon Ah du sol (fig. 6.8). Même les organismes lithoautotrophes (tableau 6.1) ont tendance à se regrouper autour des sources de matière organique. D’autres communautés tendent aussi à le faire pour leur besoin métabolique. Tous ces organismes ont constamment besoin des éléments nutritifs non carbonés du sol (p. ex. les bactéries nitrifiantes ont besoin d’éléments nutritifs minéraux réduits comme l’ammonium (NH4+) ou l’ammoniac (NH3)). Cela dit, même s’ils sont en plus faible abondance, les microorganismes et autres hétérotrophes seront toujours présents dans un profil de sol s’il y a des ressources disponibles. L’importance des biofilms microbiens dans et autour des particules primaires du sol et des agrégats mérite également d’être mentionnée. Bien que les microorganismes mobiles du sol soient importants, y compris les protozoaires définis comme étant mobiles, la plupart des bactéries du sol sont attachées aux particules du sol ou résident dans des biofilms. Les biofilms se forment lorsque des microorganismes, même éloignés les uns les autres, produisent des composés extracellulaires collants. Cela leur sert d’habitat relativement stable au sein duquel des interactions trophiques peuvent avoir lieu, permettant ainsi à ces communautés de microorganismes de construire leur propre niche.

Qu’en est-il de la distribution des organismes du sol à plus grande échelle ? Par exemple, est-ce l’on retrouve sur différents continents les mêmes espèces et les mêmes communautés dans des sols similaires ? C’est une question intrigante à laquelle nous ne pouvons offrir une réponse complète jusqu’à maintenant. En ce qui concerne les plus gros organismes, en l’absence d’humains qui facilitent les invasions biologiques en introduisant intentionnellement ou non des espèces, la réponse est probablement « non ». Pensez à l’exemple du lombric commun ci-dessus : il existe encore aujourd’hui des « fronts d’invasion » de ces vers de terre dans les forêts au Canada et aux États-Unis suite à leur introduction par les premiers colons arrivés en Amérique du Nord. Qu’est-il advenu des plus petits organismes qui ont tendance à dominer l’activité biologique non végétale dans les sols — les bactéries, les archées, les protozoaires et les phases unicellulaires des champignons ? On doit au néerlandais Martinus Beijerinck, l’un des premiers microbiologistes de l’environnement du début des années 1900 et plus tard à Lourens Baas-Becking l’affirmation de l’hypothèse selon laquelle « Tout est partout, mais l’environnement sélectionne ». Essentiellement, il y a un « ensemencement » de microorganismes à l’échelle planétaire étant donné leur petite taille (p. ex. ils pourraient être transportés sur de petites particules de poussière dans l’atmosphère) ; ils s’épanouissent lorsque les conditions et les ressources leur sont favorables, quel que soit l’endroit où se trouvent ces conditions et ces ressources. Dès lors, le paradigme voulant que la taille des organismes soit un critère de la distribution naturelle du biote (y compris du biote du sol) demeure valable. Cependant, pour avoir foulé presque tous les sols de la planète, l’humain s’est trouvé à jouer, volontairement ou non, le rôle de disperseur d’espèces et à ce titre, sa contribution à l’explication de la distribution du biote se révèle tout aussi importante que la taille des organismes.
Comment fait-on pour savoir qui vit dans le sol ?
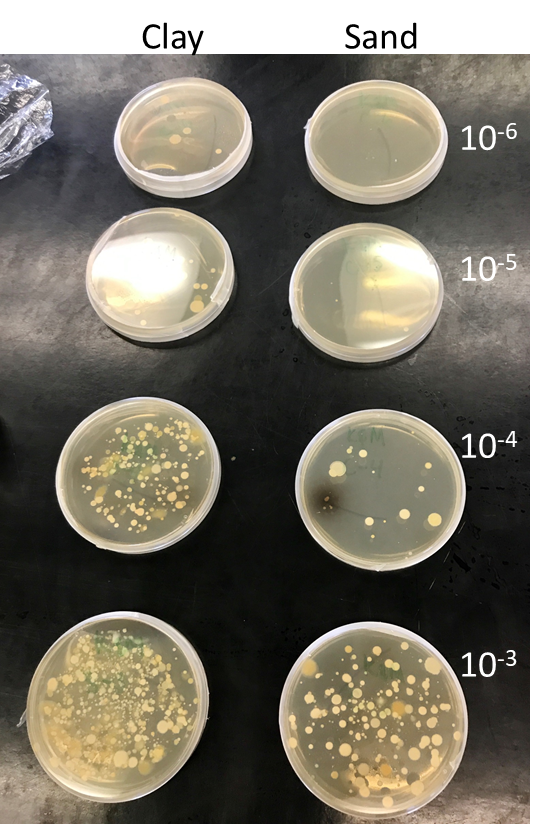
Étudier ce que nous ne pouvons pas voir facilement — à la fois parce que c’est enfoui et que c’est très petit – rend le domaine de la biologie/écologie des sols à la fois stimulant et passionnant. Si d’une part, il faut reconnaître la présence d’artéfacts et de biais analytiques dans toutes les études de l’un ou l’autre des groupes de biotes du sol, il faut reconnaître que les avancées technologiques ont beaucoup fait progresser la qualité des connaissances sur les populations, les communautés et le dynamisme de leurs interactions dans le sol. Étonnamment, c’est tout récemment que nous avons découvert que nous n’en savions pas beaucoup sur la biologie des sols. Cela a commencé avec l’observation d’un phénomène se rapportant aux bactéries d’un sol, phénomène appelé en anglais « the great plate count anomaly ». Ce phénomène a été observé après extraction d’un échantillon de sol : l’observation au microscope des cellules a montré que leur nombre était beaucoup plus élevé par rapport au nombre de cellules que l’on pouvait trouver dans les colonies cultivées en laboratoire d’un échantillon de taille similaire (fig. 6.9). Le terme « anomalie » était probablement trop fort. L’extraction et l’observation des cellules présentes dans un sol sont des méthodes relativement exemptes de biais sélectifs ; cependant, essayer de simuler en laboratoire les mêmes conditions et ressources qui existent dans un sol est extrêmement difficile. Il n’est pas surprenant que seule une petite fraction des cellules bactériennes du sol qui pouvaient être vues pût être cultivée en laboratoire. Il faudra se remémorer un instant les connaissances présentées dans les chapitre 3, chapitre 4, et chapitre 5 du manuel. La diversité et la complexité chimique, physique et écologique des sols sont immenses à très petite échelle (c.-à-d. à l’échelle des molécules d’humus avec des poids moléculaires de l’ordre de dizaines de kg par mole ; un seul gramme d’argile renferme plus de surface qu’un terrain de football !). Cette complexité à petite échelle a donné naissance à des niches biologiques pratiquement illimitées que les microorganismes du sol et autres organismes ont appris à exploiter. Prenons le seul domaine des bactéries : un gramme de sol en surface d’un écosystème productif contient des dizaines de milliards de cellules, allant de dizaines à des centaines de milliers de taxons uniques. De même, la quantité de biomasse que représente le biote du sol est également stupéfiante. Un champ cultivé peut généralement contenir 20 t ha-1 de racines, ce qui correspond environ au poids de 25 vaches et contenir 15 t ha-1 d’autres organismes du sol, ce qui correspond au poids de 20 vaches ! Cette seule observation ouvre sur une perspective vertigineuse qui à elle seule pourrait faire l’objet de plusieurs livres ! Le lecteur trouvera ci-dessous quelques exemples de défis que pose l’étude de la diversité et l’écologie des sols et en même temps les perspectives qui s’ouvrent sur les nouvelles méthodes permettant de les relever.
Observations in situ
Selon la population ou la communauté ciblée, différentes méthodes d’études du biote du sol in situ existent. La méthode « lame de contact » avec le sol consiste à insérer une lame de verre dans le sol pendant plusieurs jours à plusieurs semaines, puis à observer au microscope les microorganismes qui s’y sont attachés. Les invertébrés peuvent être observés en recourant à des pièges fosses enfouit dans le sol. Ces pièges sont des contenants à surface lisse ouverts sur le dessus qui permettent à la faune du sol d’y tomber, mais pas d’en sortir. Souvent, les pièges fosses sont partiellement remplis d’un agent de conservation comme l’éthanol pour tuer la faune piégée et empêcher sa décomposition. (Découvrez comment fabriquer un piège à fosse à l’activité 1 à la section Exercices pratiques). Une technique couramment utilisée de mesure de la quantité de vers de terre dans les sols consiste à diluer une petite quantité de moutarde en poudre (6 g) dans 1 L d’eau puis à verser la solution sur une zone définie de sol. L’effet irritant de la moutarde sur les vers les fait temporairement remonter à la surface de leur galerie souterraine, ce qui permet de les compter, les peser et d’identifier l’espèce. Il ne semble pas y avoir d’effets physiologiques négatifs à long terme de ce traitement à la moutarde (voir l’activité 2 à la section Exercices pratiques). Par ailleurs, les racines des plantes peuvent être observées et suivies in situ à l’aide de tubes transparents insérés dans le sol et d’une caméra « rhizotron » insérée périodiquement dans chaque tube. Un logiciel d’analyse d’images aide à reconnaître les mêmes racines au fil du temps et à quantifier leur croissance et leur mortalité. Enfin, pour les groupes d’organismes associés à une fonction spécifique dans le sol (souvent appelés « guildes »), leur taux d’activité peut être mesurée en quantifiant directement cette fonction au fil du temps. Par exemple, dans les sols de terrains bien drainés, les bactéries aérobies « oxydant le méthane » (méthanotrophes) consomment le méthane atmosphérique, un gaz trace et un important gaz à effet de serre, même si sa concentration dans l’air n’est que d’environ 0,00002 %. Placer une chambre fermée sur une surface définie du sol et mesurer la diminution du méthane piégé dans la chambre en fonction du temps donne une estimation raisonnable de l’activité des bactéries « oxydant le méthane » dans le sol dans des conditions naturelles.
Méthode d’isolement
La méthode de l’isolement est courante en biologie des sols ; elle consiste à étudier directement les espèces en les isolant de leur environnement et de leur communauté pédologiques (fig. 6.10). En ce qui concerne les microorganismes, l’objectif est souvent d’obtenir une culture pure (c.-à-d. une population qui se développe sur un milieu artificiel en laboratoire) qui permette de mesurer les traits physiologiques du microorganisme, y compris les ressources qu’il consomme et les produits qu’il fabrique, et qui permette aussi de déterminer l’effet du changement des conditions de croissance comme la température sur son taux de croissance et de survie. On a beaucoup appris en cultivant les microorganismes, mais c’est une méthode très sélective, qui commande la sélection d’une espèce parmi une communauté de milliers, voire de millions d’espèces, ce qui demeure un défi. Au cours des dernières décennies, les approches de caractérisation par l’utilisation de biomarqueurs (décrites ci-dessous) qui servent à caractériser les microorganismes du sol — en particulier celles qui recourent à des séquences d’ADN pour l’identification des taxons spécifiques — ont aidé à cibler les organismes du sol qui jouent un rôle déterminant dans l’environnement et à laisser de côté ces organismes qui poussent naturellement bien dans des conditions de laboratoire simples.

L’isolement des microorganismes sol diffère de l’isolement des invertébrés du sol car ces derniers sont suffisamment gros pour pouvoir être observés et caractérisés directement au microscope (c.-à-d. pas besoin de faire croître des populations dans des milieux de culture pour les étudier). Les nématodes peuvent être extraits à l’aide d’un système d’entonnoir de Baermann, où le sol est placé sur un filet en tissu dans l’entonnoir qui est ensuite saturé en eau. Les nématodes sont entraînés vers le bas à travers le tissu, tandis que les particules de sol y restent prisonnières. Une approche courante d’isolation des collemboles et des acariens (groupes de la « mésofaune » du sol, voir fig. 6.1) consiste à utiliser un système d’extraction à entonnoir de Tullgren (parfois aussi appelé Berlese-Tullgren). Dans ce système, une lumière incandescente au-dessus d’un entonnoir rempli de terre agit comme répulsif pour la petite faune du sol qui la déplace vers le bas jusqu’à ce qu’elle tombe dans le tube de l’entonnoir puis dans un récipient en dessous qui contient un agent de conservation liquide comme l’éthanol. Bien que des spécimens individuels puissent être obtenus par le recours à ces approches, l’identification taxonomique reste un défi majeur et nécessite beaucoup de temps et d’expertise.
Approches par biomarqueurs
Les organismes du sol contiennent différentes biomolécules qui peuvent être extraites et caractérisées chimiquement ; ces connaissances permettent d’étudier la composition de la communauté, la taille relative d’une population particulière ou d’une guilde fonctionnelle d’organismes (p. ex. des bactéries fixatrices d’azote, voir le chap. 7), ou le fonctionnement métabolique d’une communauté du sol. Ces différentes biomolécules comprennent (1) des lipides de membranes cellulaires qui varient selon de grands groupes de biotes (p. ex. les membranes cytoplasmiques des archées ont une structure éther-lipidique unique), (2) des polymères de sucre qui composent les parois cellulaires (p. ex. la cellulose dans les plantes et les algues par rapport à un composé appelé « chitine » chez les champignons et certains invertébrés ou un composé appelé peptidoglycane chez les bactéries) et (3) les incontournables acides nucléiques (ADN et ARN). L’ADN du biote du sol peut être extrait facilement en pulvérisant une matrice de sol et en liant le mélange d’acides nucléiques chargé négativement à une poudre de silice dotée d’une grande capacité d’échange cationique, mélange qui est lavé et dissout de nouveau dans de l’eau pure.
Souvent, les « gènes marqueurs » taxonomiques sont ciblés pour le séquençage et la quantification (fig. 6.11 et 6.12). Ce sont des gènes ou d’autres « régions » du génome d’un organisme retrouvés dans plusieurs, voire tous les organismes. Par exemple, on utilise souvent les gènes impliqués dans la production d’une partie du ribosome (l’usine de synthèse des protéines présente dans tous les organismes connus) pour distinguer une similitude ou une dissemblance entre les bactéries et les archées (gène de l’ARNr 16S) et les champignons (gène de l’ARNr 18S ou espaceur interne transcrit (ou Internal transcribed spacer (ITS) en anglais). Un gène codant pour une enzyme oxydase impliquée dans la respiration cellulaire (gène de la cytochrome oxydase 1 (CO1)) est souvent utilisé afin d’analyser les communautés animales dans le sol. Il est supposé que plus une séquence de gènes entre des organismes est similaire, plus ils ont connu une évolution similaire. Des techniques telles que la réaction en chaîne par polymérase (polymerase chain reaction (PCR) en anglais) et le séquençage d’ADN à haut débit sont devenues très accessibles dans les laboratoires de recherche. Un profil de communauté de sol basé sur les séquences d’ADN de millions d’individus dans un échantillon de sol peut être généré à un prix relativement bas et rapidement de nos jours (fig. 6.11 et 6.12). Il existe d’autres approches basées sur le recours aux acides nucléiques, qui permettent d’estimer le nombre de copies d’un gène particulier dans une extraction originale d’ADN d’un sol. Par exemple, l’utilisation de la PCR quantitative (qPCR) permet de mieux comprendre l’encodage d’une partie du complexe enzymatique de la nitrogénase, complexe impliqué dans la fixation de l’azote. La quantification des transcriptions de gènes (c.-à-d. l’ARN messager ou l’ARNm) avec la variation de qPCR pour caractériser l’expression génique liée à une fonction biochimique particulière peut également être réalisée. Le séquençage « shotgun » de l’ADN et de l’ARN extraits d’un sol est également un outil très puissant dans la caractérisation des communautés du sol — de même que leur potentiel biochimique et leur fonctionnement. De telles approches métagénomiques fournissent une image globale de la communauté non biaisée par la stochasticité potentiellement induits par la PCR.
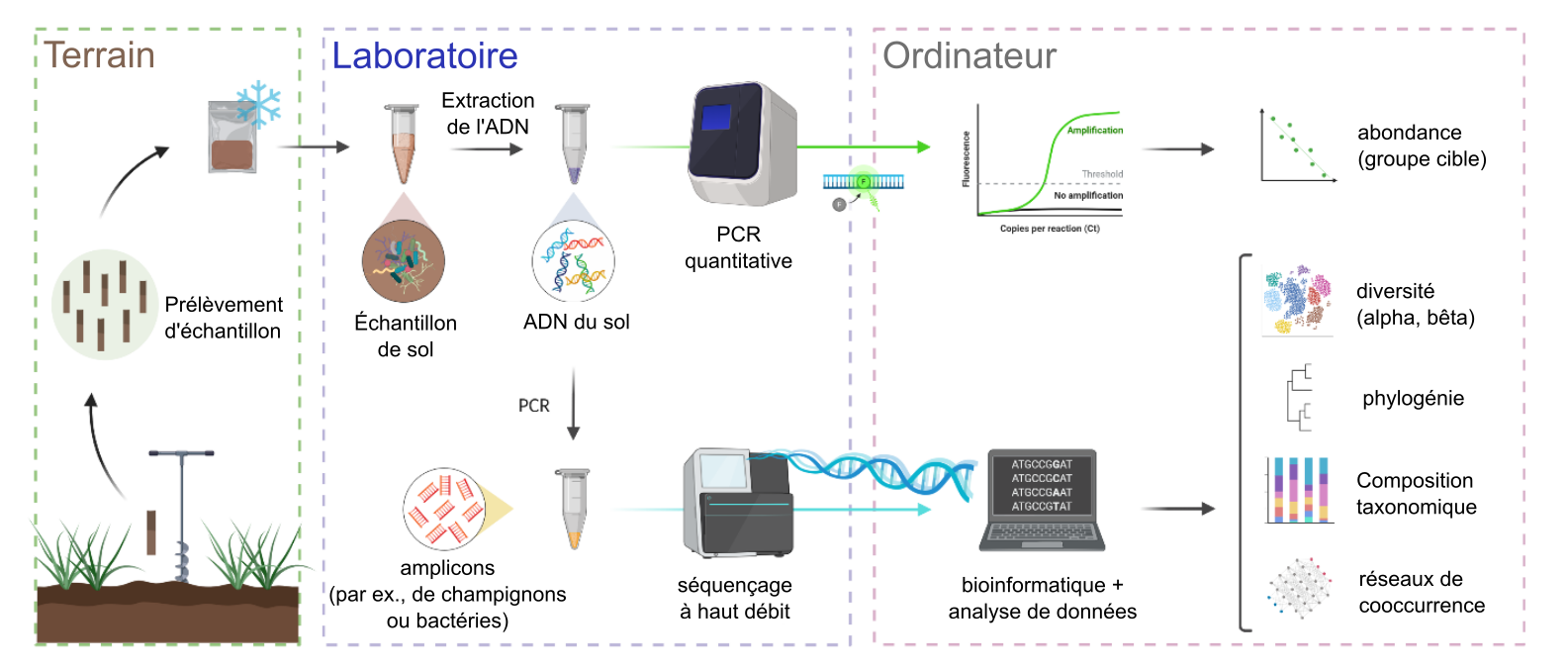

Bien que ces technologies d’extraction et de quantification peu sélectives des acides nucléiques et les technologies de séquençage peu coûteuses soient en constante amélioration, un défi majeur dans l’utilisation des analyses basées sur les séquences d’acides nucléiques des organismes et des communautés du sol réside dans le fait que très peu de taxons du biote du sol ont globalement été décrits en détail jusqu’à maintenant (p. ex. par des méthodes d’isolement et de culture). Par exemple, il n’y a qu’environ 10 000 souches uniques de bactéries qui ont identifiées dans les collections de cultures à l’échelle mondiale, tandis qu’il y a jusqu’à des milliards souches de bactéries uniques dans les sols. Les méthodes de profilage nous ont beaucoup appris sur la diversité et l’écologie du biote du sol au cours des dernières décennies, mais au moment de la rédaction de ce chapitre, elles nous ont également montré qu’il existe de nombreux « inconnus connus » à découvrir !
ÉCOLOGIE DU SOL
À quoi servent les organismes du sol ?
L’écologie décrit les interactions au sein d’une communauté biologique et l’ensemble des interactions qui se produisent avec l’environnement non biotique. Le biote du sol influence l’environnement du sol de plusieurs manières que l’on aborde tout au long de ce manuel. Par exemple, au chapitre 3, il est question de la production et de la décomposition encore mystérieuses de la matière organique du sol à laquelle participent intimement les communautés du sol ; au chapitre 4 le rôle du biote dans la formation de la structure du sol a été mis en évidence ; au chapitre 7, on apprend que les processus biologiques jouent un rôle déterminant dans la transformation des éléments nutritifs clés dans les sols. Dans ce chapitre ce sont les organismes et les communautés du sol que sont mis en scène. Les activités biologiques seront décrites du point de vue des organismes mais aussi à plus grande échelle en considérant les communautés que composent les organismes. Par exemple, nous verrons les communautés impliquées dans les processus de nitrification et de dénitrification du sol où l’azote est converti d’une forme minérale à une autre, processus déterminant la disponibilité et les pertes d’éléments nutritifs des sols et d’une grande importance à l’échelle régionale et mondiale par la façon dont ils affectent la qualité de l’eau et la composition de l’atmosphère. En mettant l’accent sur le rôle que jouent ces microorganismes dans ces processus, il sera possible de constater qu’ils exploitent les gradients redox dans l’environnement pour générer de l’énergie, croître, se reproduire et pour entrer en dormance entre les périodes de disponibilité des ressources et de conditions environnementales appropriées. Un certain nombre de fonctions importantes que le sol et ses écosystèmes connexes assurent est en fait réalisé par les communautés du sol, ou plutôt par les guildes d’organismes sous-jacentes dont les fonctions biochimiques précises finissent par créer des impacts à des échelles écosystémiques bien plus grandes que la leur. Le rôle écologique des organismes du sol a aussi des implications à l’échelle de l’écosystème, que nous aborderons dans les autres chapitres.
Décomposition, cyclage du carbone et du méthane
À l’exception des racines des plantes, le biote du sol est principalement hétérotrophe, c.-à-d. qu’il dépend de la matière organique comme source de C pour fabriquer de la biomasse (anabolisme) et comme source d’énergie (voir tableau 6.1). L’apport initial de nourriture, soit la matière organique du sol, provient principalement de la litière des plantes et du renouvellement des racines. De même, les amendements organiques comme le fumier épandu sur les cultures ou celui résultant du pâturage peuvent également constituer d’importantes sources d’alimentation. Comme il a été mentionné au chapitre 3, la qualité et la quantité de différentes litières végétales influencent le taux de décomposition et de formation d’un humus. Or, une fraction importante de cette matière organique du sol semble provenir des sous-produits microbiens issus de son traitement plutôt que de provenir de structures végétales brisées en fragments. Dans les sols bien aérés, les organismes du sol minéralisent en CO2 des composés simples et riches en éléments nutritifs comme les sucres, l’amidon, les acides nucléiques et les polypeptides à des fins de production d’énergie et d’incorporation dans la biomasse. Ils mettent plus de temps à convertir les polymères plus complexes comme la cellulose et la chitine et les polymères aromatiques comme la lignine en forme minéralisée. Le rôle des sols dans le climat mondial et en tant que médiateurs du changement climatique mondial est déterminé en grande partie par le taux d’apport net de carbone immobilisé dans la biomasse végétale moins le taux de libération de dioxyde de carbone (CO2, un important gaz à effet de serre) par la respiration des hétérotrophes en fonction du taux de mortalité et de décomposition des plantes.
Qu’arrive-t-il aux hétérotrophes lorsque les sols deviennent saturés, donc que les espaces interstitiels dans le sol ne sont plus occupés par l’O2 ? Dans de nombreux sols, le phénomène de saturation se produit, mais seulement sur une courte période, soit après un épisode de pluie soit après la fonte des neiges ; cependant, dans les sols humides, la période de saturation est plutôt prolongée. Les taux de décomposition sont beaucoup plus lents sans O2 et c’est l’un des facteurs qui contribuent à la formation de sols organiques (voir l’ordre des sols organiques au chap. 8). Sur de longues périodes, le taux de croissance des plantes dépasse le taux de minéralisation des hétérotrophes. Dans les tourbières et les fens (c.-à-d. les milieux humides, soit les types d’écosystèmes avec sols organiques prédominants), les profils de sol constitués de plantes partiellement décomposées des zones humides peuvent s’étendre sur plusieurs mètres de profondeur (fig. 6.13). Sans oxygène, le biote hétérotrophe du sol doit recourir à d’autres voies biochimiques que la respiration aérobie pour générer son énergie. Les aérobies obligatoires ne sont actifs que lorsque l’O2 est disponible, tandis que les anaérobies obligatoires ne peuvent pas fonctionner en présence d’O2. Le terme anaérobie facultatif ou aérobie facultatif définit un organisme qui peut générer de l’énergie et se développer dans des conditions sans O2 ou avec O2. Les organismes fermentaires effectuent une glycolyse — générant 1 ou 2 molécules d’ATP par molécule de glucose consommée — puis des réactions de fermentation qui permettent de régénérer les molécules nécessaires à la poursuite de la glycolyse. La fermentation génère des composés réduits comme les alcools, les acides organiques et le gaz H2 comme résidus. Ces composés produisent généralement de 18 à 36 fois moins d’ATP que ce que le glucose peut fournir à un aérobie. Certaines bactéries et archées anaérobies du sol recourent à ces voies de respiration anaérobie comme processus de décomposition des litières végétales et de la matière organique du sol. Dans ces réactions, des composés autres que l’O2 sont utilisés dans la respiration cellulaire en tant qu’accepteurs terminaux d’électrons ; la dénitrification et la réduction des sulfates sont des exemples typiques de respiration anaérobie ; ce sont généralement les anaérobes facultatifs qui effectuent la dénitrification dans les sols, phénomène qui peut produire jusqu’à la moitié de l’ATP par unité de substrat en comparaison avec la respiration aérobie ; la réduction des sulfates effectuée par des anaérobies stricts produit beaucoup moins d’énergie. La méthanogénèse est une étape de décomposition anaérobie terminale qui est importante dans les sols des zones humides (voir fig. 6.13). Un groupe d’archées strictement anaérobies utilise les déchets des bactéries fermentatives du sol (notamment l’acide acétique et le H2) pour produire du méthane (CH4), avec un rendement énergétique relativement faible. Le méthane est un gaz à effet de serre d’importance mondiale qui est beaucoup plus puissant que le CO2 ; tout changement dans les émissions de méthane rejetées par les sols des zones humides fait de ceux-ci des acteurs de premier plan dans les rétroactions de la biosphère qui alimentent le changement climatique mondial. Des groupes de bactéries appelées méthanotrophes (bactéries « oxydant le méthane ») peuvent consommer du méthane et l’utiliser à la fois comme source de carbone et d’énergie. En effet, le méthane est une bonne source d’électrons pour la génération d’ATP (de même, c’est une bonne source de chaleur dans le gaz naturel !), mais il a une énergie d’activation élevée et la plupart de l’oxydation du méthane dans les sols se produit dans des conditions aérobies avec l’O2 utilisé comme un accepteur d’électrons. Dans les sols des zones humides, les méthanotrophes résident dans les horizons de surface du sol où ils peuvent obtenir du méthane qui a été produit dans des conditions anaérobies plus bas dans le sol et de l’O2 venant de l’atmosphère au-dessus ; ils peuvent jouer le rôle de « filtreur » important qui empêche une partie du méthane d’atteindre l’atmosphère et ainsi de contribuer à réduire l’effet de serre mondial. Fait intéressant, dans les sols bien drainés, en particulier ceux qui ne sont pas perturbés par l’agriculture, les méthanotrophes consomment du méthane atmosphérique, ce qui représente un puits mondial important de ce gaz à effet de serre, car ces bactéries consomment environ 5 à 10 % de tout le méthane émis chaque année.

Cycle des éléments nutritifs
Les types d’activités auxquels se livre le biote du sol pour décomposer la matière organique et minéraliser le carbone sous forme de CO2 sont également ceux qu’il déploie pour libérer des éléments nutritifs de leur forme complexe, tels que l’azote (sous forme d’ammonium) et le phosphore (sous forme de phosphate). Dans la phase anabolique (anabolisme) de son métabolisme, les organismes du sol synthétisent des molécules complexes à partir de molécules simples, telles que les éléments nutritifs prélevés du sol. Ces éléments nutritifs se trouvent temporairement non disponibles pour les racines des plantes. Le terme employé pour décrire cette situation est « immobilisation ». Le terme « assimilation » décrit par ailleurs l’absorption des éléments nutritifs par les racines. On dit donc que les organismes du sol immobilisent les éléments nutritifs et que les racines assimilent les éléments nutritifs.
Certains groupes de procaryotes ont également cette capacité anabolique qui consiste à absorber les éléments minéraux simples du sol et de les synthétiser en molécules complexes. Le processus d’immobilisation comprend aussi (1) le très spécialisé et énergivore processus de fixation de l’azote (N2) atmosphérique au cours duquel le biote le réduit puis l’intègre à des acides aminés pour former des composés azotés organiques (voir chap. 7) et (2) les processus d’oxydation des formes minérales réduites (p ex. Fe2+ → Fe3+) ou de réduction des formes minérales oxydées (p. ex. SO42- → HS–) des éléments nutritifs. Dans le cas de l’azote, cela implique (1) le processus de nitrification chimiolithotrophe (tableau 6.1) où l’ammonium ou l’ammoniac est utilisé comme source d’électrons, ces derniers se trouvant transférés à l’O2 pour la génération d’ATP (production de nitrite et de nitrate) et (2) le processus hétérotrophe anaérobie de dénitrification où le nitrate est utilisé comme accepteur d’électrons lors de la décomposition de la matière organique. De tels processus se trouvent à influencer la disponibilité de différentes formes d’azote minéral (détaillées au chap. 7). Dans la première étape de la nitrification, soit l’oxydation de l’ammonium, il y a libération des ions H+, ce qui a pour effet d’abaisser le pH du sol, une considération à laquelle les agriculteurs doivent tenir compte lors de l’épandage d’engrais minéraux à base d’ammonium. Les deux processus de nitrification et de dénitrification comprennent plusieurs étapes qui font intervenir la participation de multiples enzymes. Parmi les produits intermédiaires générés au cours de ces processus, on compte le puissant gaz à effet de serre protoxyde d’azote (N2O), réactif dans les deux processus. Cela signifie que les sols peuvent être soit des puits de N2O, soit des sources. Cela étant dit, les sources de N2O résultant de la dénitrification des sols agricoles fertilisés représentent l’une des plus importantes contributions de ce gaz à la fois aux changements climatiques et à la dégradation de la couche d’ozone stratosphérique (atmosphère supérieure). Tout comme l’azote, le soufre et le fer trouvés sous des formes réduites ou oxydées peuvent à la fois jouer le rôle de donneur d’électrons pour les microorganismes chimiolithotrophes et d’accepteur d’électrons pour les hétérotrophes anaérobies qui en ont besoin pour respirer.
Le phosphore (P) est essentiel à la croissance des organismes vivants, car il est un constituant de nombreuses biomolécules, notamment les acides nucléiques, les phospholipides et l’ATP. D’ailleurs, il est souvent le deuxième élément nutritif susceptible de limiter la productivité après l’azote. Une faible teneur en P dans le sol peut contribuer à réduire le rendement d’une plante, tandis qu’un excès de P sera lessivé du sol, ce qui pourra entraîner la prolifération de populations d’algues dans un plan d’eau douce, phénomène appelé « eutrophisation ». Le cycle du P est unique du fait qu’il ne compte pas d’étape de phase gazeuse. Le P inorganique est présent dans la solution du sol sous forme d’ions orthophosphates (H2PO4– et HPO42-). Cette forme est la seule que les plantes puissent absorber. Cette forme n’est présente qu’à de très faibles concentrations dans les sols (environ 1 à 10 µM), car elle est très réactive ; d’ailleurs elle se lie facilement avec des cations et des argiles. Dans les sols, les formes inorganiques du P (P adsorbé, minéraux primaires et secondaires) et les formes organiques du P (matière organique, biomasse microbienne, biomasse vivante) sont dites récalcitrantes. Les microorganismes aident les plantes à absorber le P via plusieurs mécanismes :
- (a) mécanisme d’expansion du système racinaire des plantes par l’association symbiotique que les racines forment avec les champignons mycorhiziens, résultant en une augmentation des interactions des racines avec les orthophosphates ; (b) mécanisme de stimulation des racines des plantes par les rhizobactéries qui libèrent des hormones dites phytostimulantes (Plant Growth Promoting Rhizobactéria—PGPR), ce qui favorise la croissance des plantes.
- mécanisme de régulation du P dans la solution de sol par la biomasse microbienne qui l’immobilise avant de le rendre disponible aux plantes au cours de son processus de renouvellement, processus qui le libère dans la solution de sol dans une forme assimilable pour elles.
- mécanisme de solubilisation du P inorganique suivant un large éventail de processus métaboliques que produisent bactéries et champignons. Ces mécanismes comprennent a) les pompes à protons (telles que les acides organiques), qui solubilisent les formes précipitées (solides) de P (p ex. les phosphates de Ca), b) les sidérophores, qui chélatent les ions métalliques associés aux formes complexées de P du sol, c) les enzymes microbiennes (telles que les phosphatases), qui peuvent hydrolyser le P organique ou d) les enzymes cellulolytiques, qui minéralisent la matière organique (voir le chap. 7 pour une explication de la « fixation du P » en fonction des formes disponibles de P dans le sol).
Il devient possible d’augmenter la disponibilité du P du sol pour les plantes en exploitant les microorganismes dotés de ces capacités. Par exemple, un champignon, le Penicillum bilaiae a été isolé pour la première fois par des chercheurs d’une station de recherche d’Agriculture Canada à Lethbridge en Alberta (Kucey, 1983). Il a ensuite été commercialisé comme premier inoculant de phosphate au Canada, JumpStart™, lequel a été enregistré dans les années 1990 en vertu de la Loi canadienne sur les engrais pour utilisation sur le blé. Il est maintenant homologué pour la plupart des cultures produites au Canada.
Transformation des polluants
Le biote du sol, en particulier certaines bactéries et archées, joue un rôle important dans le cycle des polluants métalliques et organiques. Tout comme ce qu’il peut se produire avec le fer, certains métaux comme l’arsenic peuvent à la fois servir de donneurs et d’accepteurs d’électrons pour certains microorganismes procaryotes en fonction des conditions et ressources du sol présentes (p ex. concentration d’oxygène et de matière organique disponible). Ce processus redox microbien se trouve à modifier l’état d’oxydation de l’arsenic, état qui altère sa biodisponibilité et sa toxicité. Mais contrairement au fer, l’arsenic ne joue aucun rôle dans la structuration des biomolécules. Il ne fait que causer du stress oxydatif aux cellules, rendant cet élément gravement toxique dans certains organes d’organismes complexes. Par ailleurs, le cadmium est un élément souvent présent à l’état de traces dans les engrais agricoles. En cas de fertilisation répétée, le cadmium peut finir par s’accumuler dans les sols à des concentrations qui peuvent devenir préoccupantes pour l’alimentation humaine et animale. À l’exception du fer et de l’arsenic, les procaryotes (bactéries et archées) du sol n’utilisent généralement pas les formes réduites ou oxydées des minéraux comme source d’énergie et de production d’ATP. Toutefois certains procaryotes du sol peuvent altérer les formes réduites ou oxydées d’autres métaux comme le cuivre et le nickel à la fois pour la production d’énergie et pour l’utilisation anabolique ou la détoxification. Le cuivre, par exemple, entre en petites quantités dans la composition des enzymes que produisent les bactéries méthanotrophes pour l’hydrolyse de la matière organique et l’oxydation du méthane, tandis que le nickel se révèle nécessaire en quantité trace aux archées productrices de méthane (méthanogènes). Même à des concentrations modérées, le nickel et le cuivre peuvent être très toxiques ; il suffit de penser au sulfate de cuivre, l’additif antimicrobien clé appliqué sous pression sur le bois d’œuvre pour le préserver. Il reste beaucoup à apprendre sur la façon dont les organismes du sol parviennent à la fois à utiliser les métaux comme oligo-éléments et à s’en protéger.
Dans les sols des zones humides, certaines bactéries anaérobies et archées influencent la toxicité du mercure (Hg). Dans sa forme élémentaire, le mercure est semi-volatile, de sorte qu’il peut être transporté dans le monde entier dans des masses d’air chaud. Provenant principalement de la combustion du charbon, les dépôts de mercure ont plus que doublé dans de nombreux sols. Heureusement, le mercure élémentaire (tel que retrouvé dans un vieux thermomètre) n’est pas très biodisponible pour les organismes dans les sols, cependant dans les sols des zones humides où il y a beaucoup de matière organique et de sulfates (p. ex. comme dans la tourbière de la fig. 6.13), les bactéries anaérobies sulfato-réductrices transforment le mercure inorganique en une forme organique biodisponible appelée « méthylmercure ». Le méthylmercure se déplace depuis la solution de sol jusqu’aux eaux de surface où il se bioaccumule dans les organismes puis se bioamplifie dans les réseaux trophiques aquatiques.
Les organismes d’un sol ne peuvent pas créer ou détruire les métaux polluants tels que l’arsenic, le cadmium et le mercure. Cependant, ils peuvent modifier leur biodisponibilité ou leur toxicité en altérant leur état d’oxydation ou en les incorporant dans une molécule organique simple comme le méthylmercure. Les polluants organiques qui sont généralement synthétisés pour être utilisés dans des processus industriels ou qui se forment comme sous-produits par inadvertance au cours de processus industriels à haute température peuvent être détruits. Au début de leur application en agriculture dans les années 1960, les composés organiques synthétisés par l’homme, tels que les herbicides à base de triazine (largement utilisés dans l’agriculture d’aujourd’hui) ne pouvaient être altérés par les bactéries du sol. Heureusement, au cours des années 1990 des bactéries hétérotrophes ont été isolées étant capables de se développer sur les herbicides et puis les décomposer en une forme non toxique ! De nos jours les avancées sur la transmission horizontale de gènes chez les bactéries jouent un rôle important dans la capacité de catalyser la dégradation des composés polluants synthétisés par l’Homme. Toutes les bactéries du sol ne peuvent traiter l’entièreté de notre pollution organique. Certes, il existe des bactéries dotées d’enzymes capables de catalyser la dégradation du pétrole brut et d’autres hydrocarbures déversés dans le sol, mais elles ont tendance à être peu actives, étant donné le peu d’azote et de phosphore — également nécessaires à leur croissance — que contiennent ces polluants de carburants hydrocarbonés.
Interactions plantes-microorganismes
Il existe de nombreuses interactions importantes entre les plantes et les microorganismes dans les sols. Le terme symbiose désigne l’association durable entre différents organismes vivants. L’association peut être du type mutualiste ou du type commensaliste, où l’association est profitable pour un partenaire, mais sans effet sur l’autre. La symbiose du type parasitaire désigne l’association entre un organisme qui dépend d’un autre et lui portant préjudice, mais sans le détruire (voir pathogènes et parasites ci-dessous).
La rhizosphère est une zone importante où les plantes et les microorganismes interagissent suivant ces divers modes d’associations dans des conditions écologiques spécifiques. Les décomposeurs hétérotrophes acquièrent énergie et carbone à partir du renouvellement des racines des plantes et des exsudats racinaires et, à leur tour, transforment les composés organiques d’azote et de phosphore dans leur forme (minérale) inorganique, ce qui les rend de nouveau disponibles pour les plantes. Voilà un cas général de symbiose mutualiste. Cependant, ces interactions bénéfiques aux deux parties — plantes et microorganismes — peuvent changer. En effet, en présence d’une litière végétale à faible teneur en azote, comme celle constituée de matière ligneuse, les microorganismes s’emploient à la décomposer, puis à immobiliser les éléments nutritifs du sol le temps qu’ils se développent sur cette litière riche en carbone, mais pauvre en azote, occasionnant des carences chez les plantes se trouvant ainsi privées de ces éléments nutritifs.
D’autres interactions entre les plantes et les microorganismes s’inscrivent dans des relations plus directes. Dans le processus de fixation symbiotique de l’azote, les plantes « cultivent » des bactéries fixatrices d’azote dans des nodules racinaires ; les bactéries se nourrissent de composés carbonés qu’elles tirent de al photosynthèse de la plante et, à leur tour, les bactéries utilisent une partie de l’énergie récupérée pour convertir le N2 atmosphérique en forme biodisponible pour la plante. La plante pourra par la suite procéder à la synthèse d’acides aminés, acides aminés notamment utilisés pour la formation de la chlorophylle et l’enzyme rubisco (une enzyme clé de la photosynthèse). Seuls certains végétaux et microorganismes peuvent former de telles symbioses mutualistes. Les légumineuses s’associent à un groupe de bactéries appelées « rhizobium », tandis que certaines espèces arbustives comme l’aulne et le myrique baumier s’associent avec des membres du phylum bactérien Actinobacteria. La fixation de l’azote est un processus exceptionnellement énergivore, jusqu’à 16 ATP sont consommés par molécule unique de N2 atmosphérique réduite, ce qui rend la fixation symbiotique de N avantageuse pour les plantes, car si les plantes peuvent facilement produire des composés riches en énergie par photosynthèse, les bactéries hétérotrophes libres qui fixent l’azote de l’atmosphère ne le peuvent pas. Les taux de fixation de N entre les bactéries libres et celles qui vivent en symbiose mutualiste avec les plantes sont étonnamment différents, avec des taux d’apport de N disponible dans le sol allant de 1 kg N ha-1 an-1 jusqu’à 200 kgN ha-1 an-1 !
Enfin, l’association symbiotique mycorhizienne mentionnée ci-dessus donne lieu à des interactions plantes-microorganismes du type mutualiste (voir fig. 6.3). De nombreuses espèces végétales acceptent que leurs racines soient colonisées par les champignons mycorhiziens et pour cause ! Tandis que la plante fournit au champignon des sucres, le champignon aide la plante à acquérir des éléments nutritifs du sol comme le phosphore, à éloigner les parasites des plantes et à améliorer la structure du sol dans la rhizosphère. Simple échange de bons procédés ! De récentes recherches ont montré que la relation symbiotique mycorhizienne entre les plantes et les champignons ne relevait pas du hasard : les deux montrent des préférences les uns envers les autres comme le révèle leur mécanisme de sélection. À cet égard, un champignon n’utilisera les aliments riches en carbone que lui fournira la plante sans qu’il ait également fait sa part en lui aidant à acquérir les éléments nutritifs présents en quantités limitées dans le sol comme le phosphore.
Interactions trophiques
Dans le sol, le transfert d’énergie organique et d’éléments nutritifs sous forme de molécules dans les organismes détermine les types et les niveaux de populations d’organismes de leur communauté respective. Le concept de réseau trophique du sol sert à décrire les communautés d’organismes qui vivent dans un sol pendant toute leur vie ou une partie d’elle. Les réseaux trophiques peuvent représenter le transfert d’énergie ou d’éléments nutritifs entre les organismes au sein d’une communauté, mais l’activité est surtout centrée sur le flux d’énergie organique. Ces flux extrêmement complexes sont régis par les besoins alimentaires des organismes. Les étapes de transfert d’énergie (un organisme qui en mange un autre) sont appelées interactions trophiques. Le terme trophique se rapporte à tout ce qui est relatif à la nutrition d’un tissu vivant ou d’un organe.
Les organismes autotrophes (principalement des plantes photosynthétiques, appelées producteurs primaires) constituent la base de production d’énergie organique de la plupart des réseaux trophiques du sol. Cette énergie « s’introduit » dans le sol quand des parties aériennes mortes des plantes (feuilles, tiges, troncs, résidus de culture) tombent au sol et des racines mortes se décomposent. L’énergie organique et les éléments nutritifs contenus dans les parties aériennes mortes des plantes et les racines sont utilisés ou libérés par les organismes hétérotrophes appelés simplement « décomposeurs ». Les décomposeurs comptent de nombreuses espèces de bactéries et de champignons. L’appellation générique de « consommateurs » est donnée à tous ces organismes hétérotrophes impliqués dans les interactions trophiques.
Comment les grandes parties de plantes mortes finissent-elles par disparaître dans le sol ? Il y a d’abord les microarthropodes qui s’alimentent de ces parties mortes qu’ils mâchent et déchiquètent en petits morceaux. Ils sont appelés « détritivores » ; leur principal intérêt alimentaire en plus des parties de plantes mortes est de consommer les décomposeurs (bactéries et champignons) qui s’y trouvent. L’activité de mastication et de déchiquetage des détritivores fragmente les parties aériennes mortes des plantes, ce qui a pour effet d’agrandir leur surface de contact avec l’extérieur, favorisant ainsi la colonisation des décomposeurs à leurs surfaces.
Les racines vivantes servent également de nourriture à tout un éventail d’organismes, notamment de nombreuses bactéries et champignons, de nématodes mangeurs de racines et de microarthropodes, l’ensemble de ces organismes consommateurs de racines étant appelés « herbivores » et parfois consommateurs primaires. Les herbivores peuvent être nuisibles ou bénéfiques pour les plantes. Certaines bactéries et champignons, appelés « agents pathogènes des plantes », se nourrissent de racines ; soit qu’ils tuent des parties avant de s’en nourrir, soit qu’ils se nourrissent de cellules vivantes ; dans ce dernier cas les racines finissent par mourir (fig. 6.14)
.
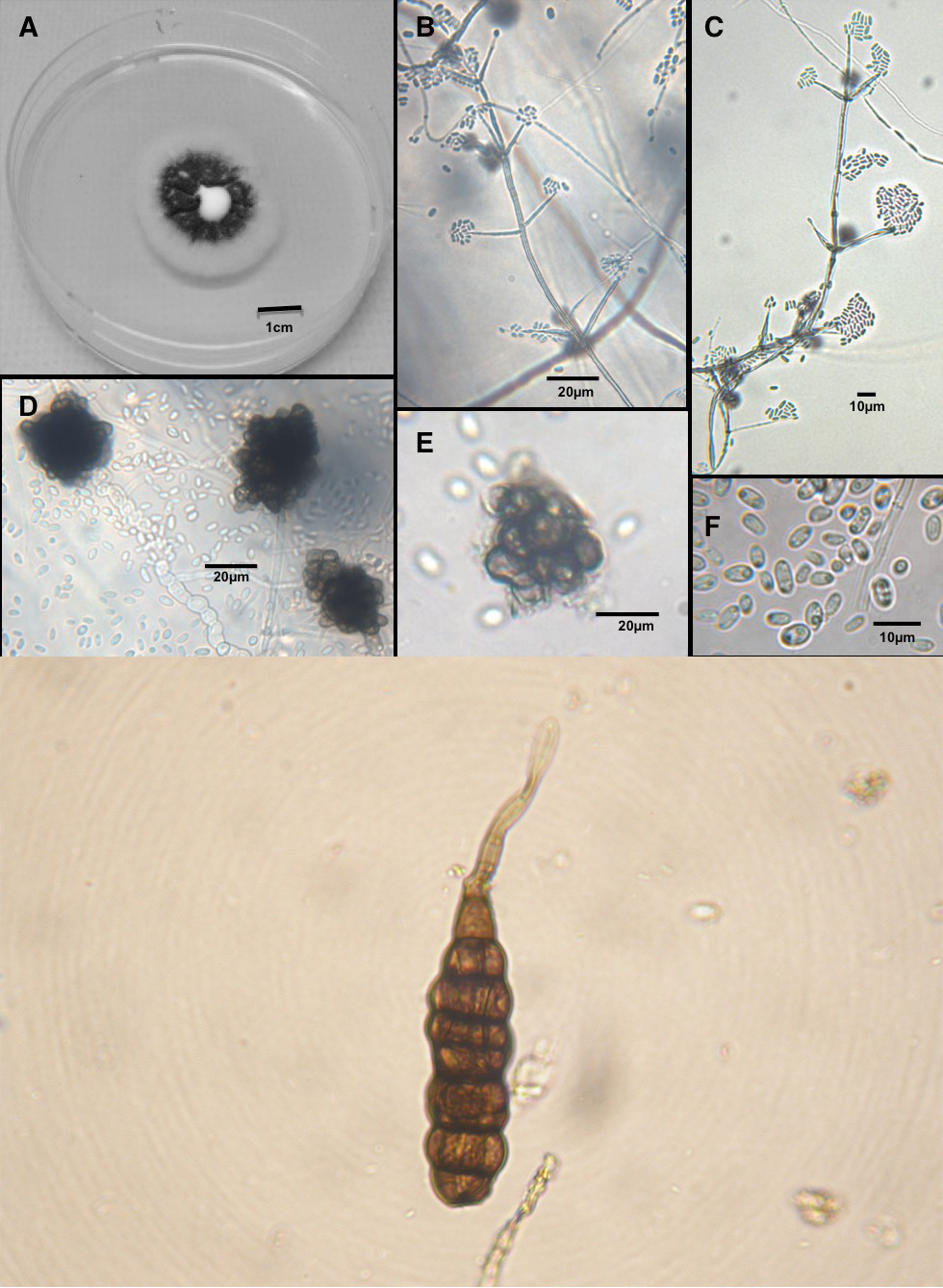
La faune du sol qui tue des parties des racines ou compromet la santé des plantes est groupée sous l’appellation « phytoravageurs » (fig. 6.15). De nombreux nématodes et microarthropodes qui se nourrissent de racines entrent dans ce groupe. Les herbivores bénéfiques tirent leur énergie des racines de plantes, mais favorisent aussi leur santé ; pour cette raison ils sont nommés les rhizo-organismes favorisant la croissance des plantes (RFCP). Ils vivent dans la rhizosphère, soit dans l’environnement immédiat des racines (autour d’elles, sur elles, à l’intérieur d’elles), autrement dit aux premières loges pour capter l’énergie des plantes. Des exemples d’herbivores bénéfiques comprennent les bactéries biologiques fixatrices d’azote qui logent dans les racines des légumineuses (p. ex. les bactéries de l’ordre des rhizobiales dans lesquelles le genre Bradyrhizobium forme des nodules sur les racines de soja) et les plantes de la famille des aulnes (p. ex. les bactéries du genre Frankia ; fig.6.16). Parmi les herbivores fongiques bénéfiques, on trouve les champignons ectomycorhiziens et arbusculaires (fig.6.3).


Les organismes qui se nourrissent de décomposeurs, de phytopathogènes, de bactéries et de champignons bénéfiques sont appelés « brouteurs microbiens » et parfois consommateurs secondaires. Ils sont considérés comme des carnivores puisqu’ils ne se nourrissent pas directement de plantes vivantes ou mortes. Les brouteurs se spécialisent : soit ils s’attaquent aux bactéries, soit aux champignons, mais rarement aux deux. À l’évidence, les brouteurs de bactéries sont des prédateurs d’organismes entiers. Les amibes, les protozoaires ciliés et flagellés, les rotifères, les nématodes bactériens et les collemboles sont tous des brouteurs de bactéries. Les tardigrades (fig. 6.17), les acariens, les collemboles et certains nématodes sont des brouteurs de champignons.
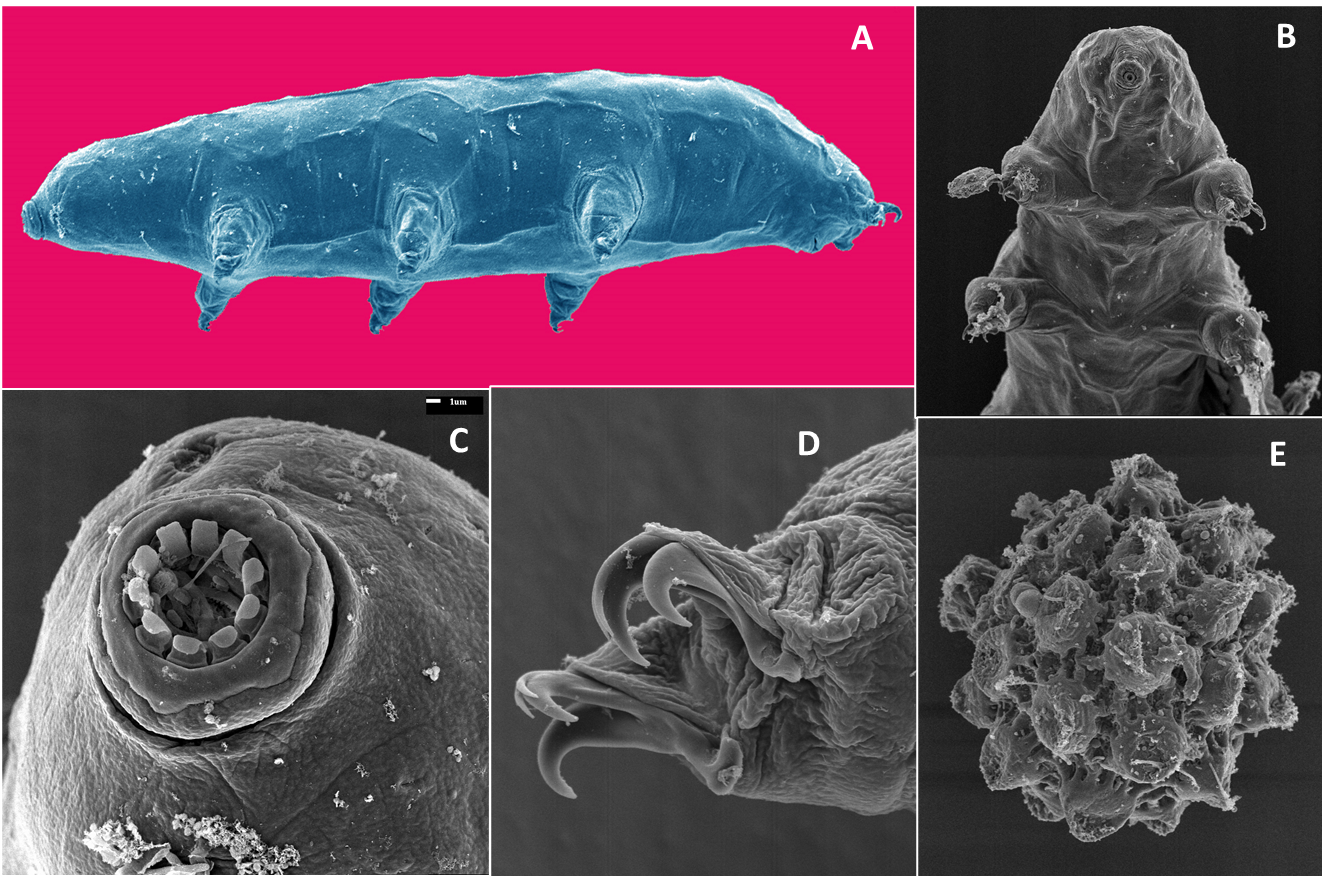
Les consommateurs tertiaires se nourrissent des brouteurs microbiens et des phytoravageurs. Ils peuvent être entièrement carnivores ou omnivores. Dans ce dernier cas, ils se nourrissent de combinaisons de champignons, d’animaux du sol, de racines vivantes et des autres parties de plante. Les nématodes omnivores, les nématodes entomopathogènes (nématodes qui tuent et se nourrissent de microarthropodes), les champignons pièges à nématodes (champignons capables d’immobiliser un nématode puis de s’en nourrir) et les nématodes et acariens prédateurs sont des consommateurs tertiaires.
Il est possible de schématiser les interactions trophiques des réseaux trophiques du sol en montrant des organismes ou des groupes trophiques reliés par des flèches qui indiquent la direction du flux d’énergie. Les réseaux trophiques du sol sont analysés en passant par ces trois étapes : (1) prélever très soigneusement un échantillon de sol, (2) procéder à toutes les méthodes de récupération des organismes qui permettront de les (3) identifier et de les dénombrer. La préférence alimentaire des organismes récupérés est déterminée à partir de deux sources d’information : à partir de la documentation qui existe déjà sur les agents pathogènes et les ravageurs qui créent un impact important sur l’économie ; à partir des observations directes des structures d’alimentation des organismes. Par exemple, on reconnaîtra les acariens prédateurs à leur structure de bouche perçante plus massive (chélicère) que celle des acariens qui se nourrissent de champignons, différence qui s’explique par la taille des proies que chaque catégorie préfère.
La figure 6.18 illustre un exemple de réseau trophique d’un sol des prairies du Nord-Est du Colorado (les organismes d’un niveau trophique similaire (de même préférence alimentaire) partagent la même colonne grise ; les flèches indiquent la direction du flux d’énergie généré par les interactions trophiques (source de nourriture/proie → consommateur/prédateur). Sur le schéma, quatre catégories de niveau trophique se distinguent : (1) les producteurs primaires, (2) les herbivores et les décomposeurs, (3) les brouteurs microbiens et (4) les consommateurs tertiaires. Notez que les acariens prédateurs occupent l’apogée du réseau trophique (carnivore supérieur).
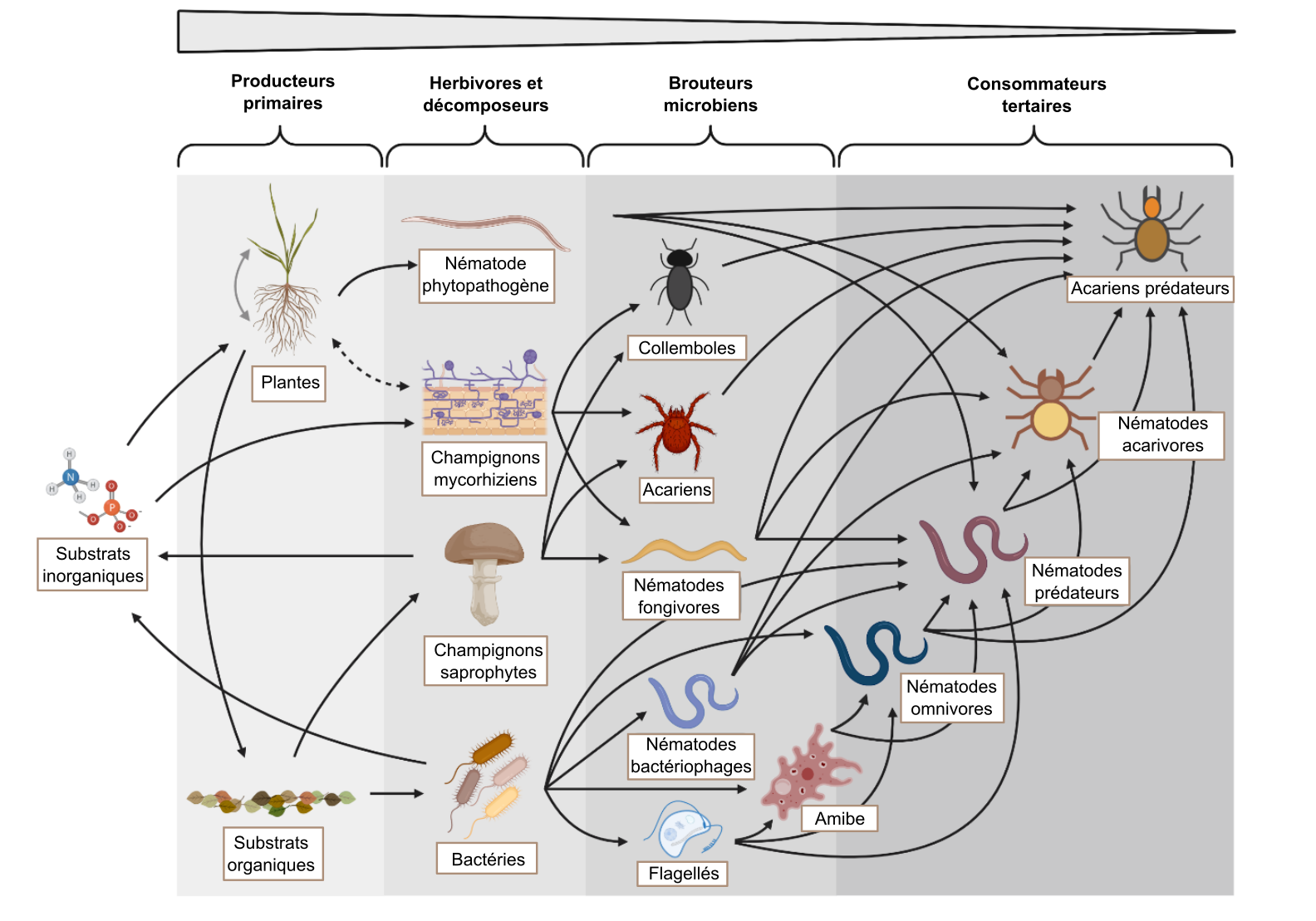
Les producteurs primaires et les consommateurs d’un réseau trophique ont des rôles importants dans le sol, ne serait-ce que pour établir un équilibre entre les populations d’organismes bénéfiques aux plantes et celles qui leur sont nuisibles. Les réseaux trophiques privés de cet équilibre défavorisent la croissance des plantes. Les processus en cause dans la préservation de l’équilibre d’un réseau trophique reposent sur la préservation des processus ascendants par rapport aux processus descendants. La quantité d’une ressource présente est déterminante sur la population de consommateurs engagés dans les processus ascendants au sein du réseau trophique du sol. Par exemple, lorsque les populations de consommateurs microbiens et de consommateurs tertiaires sont fonction de la densité des racines présentes dans un sol, il va de soi que le processus est ascendant (c.-à-d. que l’apport d’énergie des racines détermine les populations dans les interactions trophiques supérieures). Les processus descendants sont ceux où ce sont les populations de prédateurs qui déterminent celles des proies. En agriculture et en foresterie, on applique le processus descendant pour lutter contre les organismes nuisibles, processus nommé lutte biologique dans ce contexte. Dans un tel contexte, la santé d’une plante affectée par un herbivore se trouve améliorée par l’ajout d’un de ses prédateurs dans le réseau trophique. Parmi les agents de lutte biologique figurent les nématodes entomopathogènes qui tuent les vers des pelouses et les acariens prédateurs grâce à qui on peut maîtriser les populations de moucherons et de thrips.
Les réseaux trophiques du sol sont conformes au principe de la pyramide écologique. Les réseaux trophiques du sol ont généralement des quantités élevées d’énergie emmagasinée dans la biomasse des producteurs primaires (c.-à-d. les plantes) ; la quantité d’énergie/biomasse diminue chez les décomposeurs, les brouteurs microbiens et enfin chez les consommateurs tertiaires, dont la biomasse globale est la plus petite de toute dans une zone donnée du sol. Cela souligne toute l’importance que jouent les processus ascendants qui se produisent dans les réseaux trophiques d’un sol donné. La figure 6.18 montre que dans une prairie typique, les racines des plantes constituent la plus grande biomasse de tous les organismes du sol, suivies des champignons et des bactéries (en grande partie des décomposeurs) puis des brouteurs microbiens. Lorsqu’ils sont présents, les vers de terre se nourrissent et tirent leur énergie des détritus, des bactéries et des champignons qui se trouvent dans le sol qu’ils ingèrent.
Le phénomène hiérarchisé des échanges d’énergie qui ont lieu dans le sol se déroule selon la même hiérarchie pyramidale d’échanges d’énergie que celle qui se produit au-dessus du sol (pyramide écologique du réseau trophique). Chaque interaction trophique (activité alimentaire) entraîne une perte d’énergie organique sous forme de chaleur. Cela signifie qu’il y a de moins en moins d’énergie transférée dans le réseau trophique. La science n’a pas de preuve selon laquelle les organismes du sol produiraient de la chaleur comme le font les mammifères. Cependant, ceux ayant déjà fait du compost, savent que les températures peuvent atteindre 65 °C à l’intérieur d’un tas imposant. Le compost est un excellent isolant thermique, car il est capable de retenir la chaleur produite par les décomposeurs (fig. 6.19). Un autre facteur déterminant dans le phénomène hiérarchisé des échanges d’énergie qui a lieu dans le sol réside dans l’énergie que doivent dépenser les prédateurs à la recherche de proies, et du fait qu’ils peuvent vivre plus longtemps qu’elles.

SOMMAIRE
- La très grande diversité de niches chimiques, physiques et écologiques que retrouvée dans les sols a favorisé l’essor d’une gamme diversifiée d’organismes du sol, allant des bactéries microscopiques à la faune vertébrée ; ces niches sont autant nécessaires à la vie qu’elles sont créées par elle.
- Le nombre élevé de bases de données de petite taille et le manque d’expertise en taxonomie présentent des obstacles énormes à notre compréhension de l’ampleur de la diversité biologique contenue dans les sols. Il y a encore tant à découvrir !
- Bien que les organismes qui vivent dans le sol soient avant tout des hétérotrophes (c.-à-d. qui s’alimentent de substances organiques), les organismes autotrophes n’y jouent pas moins un rôle clé par leur capacité à utiliser directement le dioxyde de carbone (CO2) comme source de carbone et leur énergie directement du soleil (les phototrophes) ou de source énergétique chimique (les chimiotrophes). Ces stratégies métaboliques leur permettent d’exploiter directement les ressources brutes de leur environnement pour tirer leurs éléments nutritifs et leur énergie.
- Si ces stratégies sont à la base de l’activité métabolique des organismes vivants — génération d’ATP, survie et reproduction — l’exploitation des ressources du sol que ces processus métaboliques impliquent contribue également au fonctionnement des processus qui se produisent dans le sol, tels qu’entre autres, le cycle de la matière organique et des éléments nutritifs (influant sur la fertilité du sol).
- Le réseau trophique du sol désigne l’ensemble des relations alimentaires qui existent au sein de l’écosystème du sol entre les diverses catégories écologiques d’organismes vivants qui le constituent : producteurs primaires, herbivores, décomposeurs, brouteurs microbiens et consommateurs tertiaires. En général, c’est la quantité de matière organique produite par les producteurs primaires (par photosynthèse des végétaux) qui entre dans le sol qui détermine la structure des niveaux trophiques (leur biomasse). Les flux de matière et d’énergie sont souvent représentés par des schémas appelés pyramides alimentaires ou pyramides écologiques.
LECTURE SUGGÉRÉE
Coleman, D., Callaham, M. and Crossley, D. 2017. Fundamentals of Soil Ecology. 3rd Ed. Academic Press, London, UK.
De Wit, R. and Bouvier, T. 2006. ‘Everything is everywhere, but the environment selects’; what did Baas Becking and Beijerinck really say? Environ. Microbiol. 8: 755-758.
Hunt, H.W., Coleman, D.C., Ingham, E.R., Ingham, R.E., Elliott, E.T., Moore, J.C., Rose, S.L., Reid, C.P.P., and Morley, C.R. 1987. The detrital food web in a shortgrass prairie. Biol. Fertil. Soils 3:57–68.
Kingston, W. 2004. Streptomycin, Schatz v. Waksman, and the Balance of Credit for Discovery. Journal of the History of Medicine and Allied Sciences 59:441-462.
Kucey, R. M. N. 1983. Phosphate-solubilizing bacteria and fungi in various cultivated and virgin Alberta soils. Can. J. Soil Sci. 63:671_678
Madsen, E.L. 2015. Environmental Microbiology: From Genomes to Biogeochemistry. 2nd Edition. Wiley-Blackwell, Hobokon, NJ.
Nair, P. 2012. Woese and Fox: Life, rearranged. P.N.A.S 109: 1019–1021.
Paul, E.A. 2015. Soil Microbiology, Ecology and Biochemistry, 4th Edition. Academic Press, Boston, MA.
Richardson, AE., and Simpson, R.,J. 2011. Soil microorganisms mediating phosphorus availability update on microbial phosphorus. Plant Physiol. 156: 989-996. DOI: 10.1104/pp.111.175448
Schmitt, C.L., and Tatum, M.L. 2008. The Malheur National Forest:Location of the World’s Largest Living Organism [The Humongous Fungus]. United States Department of Agriculture- Forest Service. Available from http://www.fs.usda.gov/Internet/FSE_DOCUMENTS/fsbdev3_033146.pdf [accessed 26 October 2020].
Simard, S., Perry, D., Jones, M., Myrold, D.D., Durall, D.M. and Molina, R. 1997. Net transfer of carbon between ectomycorrhizal tree species in the field. Nature 388:579–582
Swift, M.J., Health, O.W., Anderson, J.M. 1979. Decomposition in Terrestrial Ecosystems. University of California Press, Berkley, CA.
EXERCICES PRATIQUES
- Pourquoi la diversité des bactéries dans le sol est-elle si élevée ? Quels rôles viennent jouer les propriétés du sol dans les interactions trophiques entre les organismes vivant dans le sol, présents en si grande diversité ?
- Quelles sont les approches d’étude des communautés biologiques du sol basées sur les biomarqueurs et l’isolement ? Pourquoi les approches basées sur les biomarqueurs sont-elles particulièrement utiles dans la caractérisation de la diversité des organismes de petite taille dans le sol ?
- Choisissez un exemple d’organismes du sol qui entretiennent une relation symbiotique mutualiste et un autre exemple d’organismes qui entretiennent une relation parasitaire.
- Où se trouve généralement la biomasse la plus importante dans un profil de sol et pourquoi ? Décrivez ce que vous avez trouvé au regard des stratégies métaboliques des différentes catégories écologiques d’organismes (hétérotrophes, lithotrophes, autotrophes) présents dans l’écosystème « sol ».
- Imaginez un sol stérile entièrement dépourvu de biote (de tout organisme vivant). Des plantes parviendraient-elles à croître sur ce sol ? Expliquez.
- Décrire les différences entre un biote vivant dans un sol d’une zone humide (milieu anoxique) inondée par rapport à un biote vivant dans un sol bien drainé.
- De quelle façon le biote du sol influence-t-il le cycle du carbone à la fois dans le sol et dans l’atmosphère ?
- Représenter schématiquement un réseau trophique de sol.
Matière à réflexion !
Activités
Activité 1: Fabriquez un piège à fosse pour attraper des invertébrés et des insectes du sol
Adapté de : https://www.nhm.ac.uk/discover/how-to-make-pitfall-trap-to-catch-insects.html
Vous aurez besoin :
- d’une truelle à main
- d’un petit récipient en plastique (ou un gobelet en plastique)
- d’un plateau
- de guides d’identification (facultatif)
- Repérez un terrain plat situé près d’une zone végétation pour y placer le piège à fosse.
- Creusez un petit trou avec la truelle.
- Placez le récipient (ou le gobelet) dans le trou. Le récipient (ou le gobelet) doit être propre. Comblez de sol tout espace vide autour du récipient. S’assurer que le haut du récipient est au même niveau que le sol (sinon, vous n’attraperez rien).
- Laissez le piège toute une nuit.
- Videz ensuite le contenu du piège sur un plateau et examinez les créatures présentes. Recourez aux guides d’identification ou à des applications telles que iNaturalist (soutenue par la Fédération canadienne de la faune et le Programme de biodiversité du Musée royal de l’Ontario https://inaturalist.ca/) pour identifier les petits invertébrés que vous aurez trouvés.
- Décrivez ce que vous avez trouvé ; prenez des photos ; énumérez les genres de créatures trouvées. N’oubliez pas d’indiquer les lieux et date de vos découvertes.
- Relâchez soigneusement les petites créatures dans un endroit sûr et abrité.
- S’assurer d’avoir remis l’emplacement de l’expérience dans le même état que vous l’avez trouvé.
Activité 2: Dénombrement de vers de terre
Adapté de : Christina Curell, Michigan State University Extension – 29 juin 2016
https://www.canr.msu.edu/news/earthworms_can_be_an_indicator_of_soil_health
Matériel dont vous aurez besoin pour mesurer les vers sur le terrain :
- d’un ruban à mesurer (graduation métrique)
- de 2 litres d’eau
- d’une truelle à main ou d’une pelle
- d’un contenant d’entreposage des vers
- d’une solution composée de 2 cuillères à soupe de moutarde en poudre dissoute dans 2 litres d’eau
Vous voilà prêt pour l’expérience du dénombrement !
Étape 1: Délimitez une zone de 30 x 30 cm ; au centre, creusez-y un trou d’environ 30 cm de profondeur (12 pouces)
Étape 2: Collectez et comptez le nombre de vers trouvés dans la terre excavée. Si possible, tentez de différencier les types de vers. Par exemple, différenciez les vers de terre des vers rouges, etc.
Étape 3: (facultative) : Nivelez le fond du trou et versez-y lentement la solution de moutarde. Les vers du type fouisseur devraient remonter à la surface dans les 5 minutes suivantes. Collectez les vers qui auront remonté à la surface puis dénombrez-les.
Étape 4: Comptez le nombre total de vers de terre que vous avez collectés.
Les Auteurs
Nathan Basiliko, Professor and Canada Research Chair in Environmental Microbiology, Department of Biology, Laurentian University
 My research group focuses nearly entirely on soil biology and the roles in biogeochemical cycles. However, because my academic “home” for the past 7 years at Laurentian University has been in our Biology department, I don’t teach soil science courses anymore (I used to). I miss teaching introductory soil science in particular, but my current position does give me a new opportunity to squarely build soil science in to other courses- including introductory and advanced microbiology and ecosystem ecology courses. I hope that this has some broader impact by engaging students with soil science who otherwise would not take soil science courses.
My research group focuses nearly entirely on soil biology and the roles in biogeochemical cycles. However, because my academic “home” for the past 7 years at Laurentian University has been in our Biology department, I don’t teach soil science courses anymore (I used to). I miss teaching introductory soil science in particular, but my current position does give me a new opportunity to squarely build soil science in to other courses- including introductory and advanced microbiology and ecosystem ecology courses. I hope that this has some broader impact by engaging students with soil science who otherwise would not take soil science courses.
Kari Dunfield, Professor in Applied Soil Ecology and Canada Research Chair in Environmental Microbiology of Agro-Ecosystems, School of Environmental Sciences, University of Guelph
 Kari Dunfield (licensed under a CC-BY-NC-ND license)Kari is a Professor in Applied Soil Ecology and Canada Research Chair in Environmental Microbiology of Agro-Ecosystems in the School of Environmental Sciences at the University of Guelph (Guelph, Ontario). Her research group works at the intersection of microbiology, ecology, and soil science, and takes an inter-disciplinary approach to find solutions to complex global environmental challenges, including, recycling nutrients and minimizing greenhouse gas emissions in agriculture systems; breaking down pollutants in brownfield sites; and understanding pathogen transport from agricultural systems into waterways. I love studying soil microbiology because it is a combination of field and lab based research. In my group you need to own a pair of steel toed boots and a lab coat, because in the morning you could be going out to the field, using soil probes and shovels to get soil and root samples, and in the afternoon you could be back in the lab doing delicate and sterile molecular biology techniques.
Kari Dunfield (licensed under a CC-BY-NC-ND license)Kari is a Professor in Applied Soil Ecology and Canada Research Chair in Environmental Microbiology of Agro-Ecosystems in the School of Environmental Sciences at the University of Guelph (Guelph, Ontario). Her research group works at the intersection of microbiology, ecology, and soil science, and takes an inter-disciplinary approach to find solutions to complex global environmental challenges, including, recycling nutrients and minimizing greenhouse gas emissions in agriculture systems; breaking down pollutants in brownfield sites; and understanding pathogen transport from agricultural systems into waterways. I love studying soil microbiology because it is a combination of field and lab based research. In my group you need to own a pair of steel toed boots and a lab coat, because in the morning you could be going out to the field, using soil probes and shovels to get soil and root samples, and in the afternoon you could be back in the lab doing delicate and sterile molecular biology techniques.
Mario Tenuta, Professor of Applied Soil Ecology and Senior Industrial Research Chair in 4R Nutrient Stewardship, Department of Soil Science, University of Manitoba
 As a Soil Ecologist, the work is very diverse and full of new challenges and learning opportunities. My research involves tackling the issue of lowering the amount of greenhouse gases emitted from agricultural soils. For this we do field research to understand how microbes are involved in nutrient cycling, how soil conditions affect microbial activities and functions and how farmer practices of fertilizer and manure use affect microbes. There is lots of opportunity for laboratory analysis of microbes, nutrients in soil, nutrients in plants, and of crop productivity. We take that understanding to recommend practices farmers can use to lower emissions of important greenhouse gases such as nitrous oxide (N2O). Soil is everywhere and the work also provides lots of opportunity to travel locally and the world doing research, teaching and development
As a Soil Ecologist, the work is very diverse and full of new challenges and learning opportunities. My research involves tackling the issue of lowering the amount of greenhouse gases emitted from agricultural soils. For this we do field research to understand how microbes are involved in nutrient cycling, how soil conditions affect microbial activities and functions and how farmer practices of fertilizer and manure use affect microbes. There is lots of opportunity for laboratory analysis of microbes, nutrients in soil, nutrients in plants, and of crop productivity. We take that understanding to recommend practices farmers can use to lower emissions of important greenhouse gases such as nitrous oxide (N2O). Soil is everywhere and the work also provides lots of opportunity to travel locally and the world doing research, teaching and development