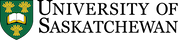Se creuser la tête
7 Cycles des éléments nutritifs du sol
Joann Whalen; Noura Ziadi; Jeff Schoenau; Maxime C. Paré; David Burton; and Tom Bruulsema
OBJECTIFS D’APPRENTISSAGE
À la fin de ce chapitre, les étudiants seront capables de :
- Connaître les formes de nutriments du sol qui peuvent être acquises par les plantes.
- Connaître les facteurs contrôlant les transformations des nutriments en formes assimilables par les plantes.
- Comprendre comment évaluer la fertilité du sol avec des tests de sol et des analyses des plantes.
- Comprendre que les engrais inorganiques et organiques peuvent être appliqués pour reconstituer l’approvisionnement en éléments nutritifs du sol.
- Connaître l’approche des 4R pour la gestion des éléments nutritifs du sol.
- Être conscient des implications environnementales de la gestion des éléments nutritifs du sol.
- Connaître quelques exemples d’amélioration de la fertilité des sols au Canada.
INTRODUCTION
Les sols assurent le support à la croissance des plantes. Les graines germent rapidement dans un sol chaud et humide. La plantule émerge à la surface du sol, qui doit être poreux et non compacté, sans croûte superficielle. L’allongement et le développement du système racinaire se produisent facilement dans un sol à structure friable et instable. Le système racinaire assure deux fonctions vitales. La première étant une fonction d’ancrage. De nombreuses plantes développent une racine primaire grosse et forte qui est approximativement aussi haute que la tige. Une plante qui est fermement enracinée dans le sol sera peu susceptible d’être délogée par les précipitations et les tempêtes de vent. La deuxième fonction vitale du système racinaire est d’approvisionner la plante en ressources : presque toute l’eau et de nombreux éléments essentiels à la croissance d’une plante sont absorbés par les poils absorbants des racines (tableau 7.1).
Table 7.1. Éléments essentiels et formes nutritives des cations, anions et molécules absorbés par les racines des plantes (adapté de Havlin et al. 2014)
| Élément essentiel | Concentration | Forme(s) nutritive(s) absorbée(s) | ||
|---|---|---|---|---|
| (μg g-1 masse sèche) | Cation | Anion | Molécule | |
| C | 450000 | CO2 1 | ||
| H | 450000 | H2O 2 | ||
| O | 60000 | CO2, H2O | ||
| N | 15000 | NH4+ | NO3- | N2 3 |
| K | 10000 | K+ | ||
| Ca | 5000 | Ca2+ | ||
| P | 2000 | HPO42-, H2PO4- | ||
| S | 2000 | SO42- | SO2 4 | |
| Mg | 1000 | Mg2+ | ||
| Fe | 100 | Fe2+, Fe3+ | chélat soluble 5 | |
| Cl | 100 | Cl- | ||
| Mn | 50 | Mn2+ | chélat soluble | |
| B | 20 | H2BO3- | H3BO3, chélat soluble | |
| Zn | 20 | Zn2+ | chélat soluble | |
| Cu | 6 | Cu2+ | chélat soluble | |
| Mo | 0.1 | MoO4- | chélat soluble | |
| Ni | 0.01 | Ni2+ | chélat soluble | |
| 1 CO2 Le CO2 est absorbé par les feuilles et converti en glucides (CH2O)n par photosynthèse. 2 H2O, à l’état de vapeur ou à l’état liquide, est absorbée par le feuillage et les racines. 3 Des procaryotes fixateurs de N2,symbiotiques et associatifs, qui se développent avec la plante, transforment le gaz N2 en NH4+ via la fixation biologique de l’azote, puis transporté dans les cellules végétales. 4 Moins de 10 % des besoins en soufre de la plante proviennent du SO2 gazeux absorbé par les feuilles. 5 Les chélats solubles sont facilement absorbés par les racines. |
||||
La « fertilité du sol » définit la capacité du sol à fournir des ions nutritifs pour la croissance des plantes. Les sols ont une fertilité inhérente, qui dépend de quatre facteurs :
- du matériau d’origine, qui libère les minéraux nutritifs par altération;
- de la végétation, qui libère des éléments nutritifs par décomposition de ses résidus organiques;
- des organismes qui participent à l’altération et ceux qui participent à la décomposition et au cycle des éléments nutritifs;
- du climat, qui détermine les taux des processus biologiques, chimiques et physiques qui réduisent ou contribuent à l’approvisionnement en éléments nutritifs du sol.
La fertilité inhérente du sol est un bon indicateur prévisionnel des espèces végétales qui pousseront dans une zone donnée dans des conditions naturelles, sans intervention humaine. La récolte des cultures agricoles destinées à nourrir les gens et le bétail a pour effet de prélever certains éléments nutritifs du système sol-plante. C’est pourquoi les agroécosystèmes sont fertilisés pour réapprovisionner le sol des éléments nutritifs qui en ont été prélevés. Il faut être prudent en matière de sélection du bon engrais et autres amendements du sol; non seulement ils sont coûteux, mais leur surutilisation sur les terres agricoles peut avoir des conséquences environnementales négatives. L’application d’engrais dans les sols agricoles canadiens doit découler de plans de gestion des éléments nutritifs de façon à optimiser le rendement agricole dans le contexte du respect d’impératifs d’ordre économique et environnemental.
ÉLÉMENTS NUTRITIFS DANS LE SYSTÈME SOL-PLANTE
Les racines fines et les poils absorbants poussent dans les pores du sol, qui contiennent de l’air et de l’eau. L’eau interstitielle du sol est une solution d’électrolytes diluée contenant des ions nutritifs solubles. Pour satisfaire leur besoin en eau, les plantes absorbent les molécules d’eau du sol par osmose qu’elles conduisent ensuite par l’intermédiaire des aquaporines à l’intérieur de leurs cellules et hors d’elles, ce qui permet de réguler le volume cellulaire et la pression osmotique interne. Les ions solubles dans l’eau interstitielle du sol pénètrent dans les poils absorbants et diffusent à travers l’épiderme. Cependant, la surface des racines doit conserver la neutralité électrique. Tout ion qui pénètre dans la racine provoque la libération d’un contre-ion, tel que H+, OH– ou HCO3– (figure 7.1). Par exemple, lorsqu’un ion chargé positivement tel que le potassium (K+, un cation) traverse l’épiderme de la racine, celle-ci libère un ion H+ dans l’eau interstitielle du sol environnant, tandis que l’absorption d’un ion calcium (Ca2+) entraîne la libération de 2 H+ dans l’eau interstitielle du sol.
Une fois à l’intérieur de la racine, les ions hydrosolubles peuvent se déplacer dans l’apoplaste du cortex, voie de transport par laquelle l’eau et les substances dissoutes cheminent le long des parois cellulaires et de l’espace extracellulaire à l’extérieur des membranes plasmiques. Il existe deux autres voies de déplacement des ions hydrosolubles : la voie symplastique et la voie transmembranaire. Par la voie symplastique, l’eau et les solutés se déplacent le long du cytosol en traversant les membranes plasmiques des cellules adjacentes par l’intermédiaire des plasmodesmes. Par la voie transmembranaire, les minéraux dissous et l’eau se déplacent de cellule en cellule en traversant la paroi cellulaire, sortant d’une cellule avant d’entrer dans la cellule suivante. La couche subérisée qui entoure l’endoderme agit comme une barrière physique, de sorte que les ions doivent passer par des canaux protéiques (en se liant à des protéines de transport) s’ils veulent « réussir » à traverser la membrane plasmique. Certaines de ces protéines de transport d’ions nutritifs dans les plantes sont présentées dans le tableau 7.2. Les ions nutritifs passent ensuite dans le xylème puis filent avec l’eau en direction de la tige, des feuilles, des fleurs, des graines et autres composantes. Les ions nutritifs peuvent s’incorporer dans des composés structuraux au sein de ces organes végétaux, ou soutenir des processus métaboliques dans le cytoplasme. De plus, ils peuvent être remobilisés et déplacés de nouveau vers d’autres tissus ou organes de toute autre partie de la plante qui les requièrent.
Tableau 7.2 Protéines de transport assurant le passage des ions nutritifs à travers les membranes plasmiques des plantes vasculaires. Adapté de Reid et Hayes (2003)
| Ions nutritifs | Protéines de transports | Commentaires |
|---|---|---|
| NH4+ | Protéines transporteuses AMT de haute affinité | |
| NO3- | Famille de protéines de transport de nitrate (NRT2) | |
| H2PO4- and HPO42- |
Protéine de transport PHT1 | PHT1;1 à PHT1;9 ont été détectés chez Arabidopsis thaliana |
| K+ | Famille de protéines de transport K+ (Trk) K+ | |
| SO42- | Protéine de transport SO42- | Les plantes possèdent également le transporteur de cystéine (Cys), le transporteur de méthionine (Met) et le transporteur de glucosinolate (GSL) |
| Ca2+ | ransporteurs de Ca2+, ATPases de Ca2+ et antiporteurs de H+/Ca2+ | Les protéines de transport qui déplacent le Ca2+ à travers la membrane contre le gradient électrochimique portent le nom de pompe ionique. |
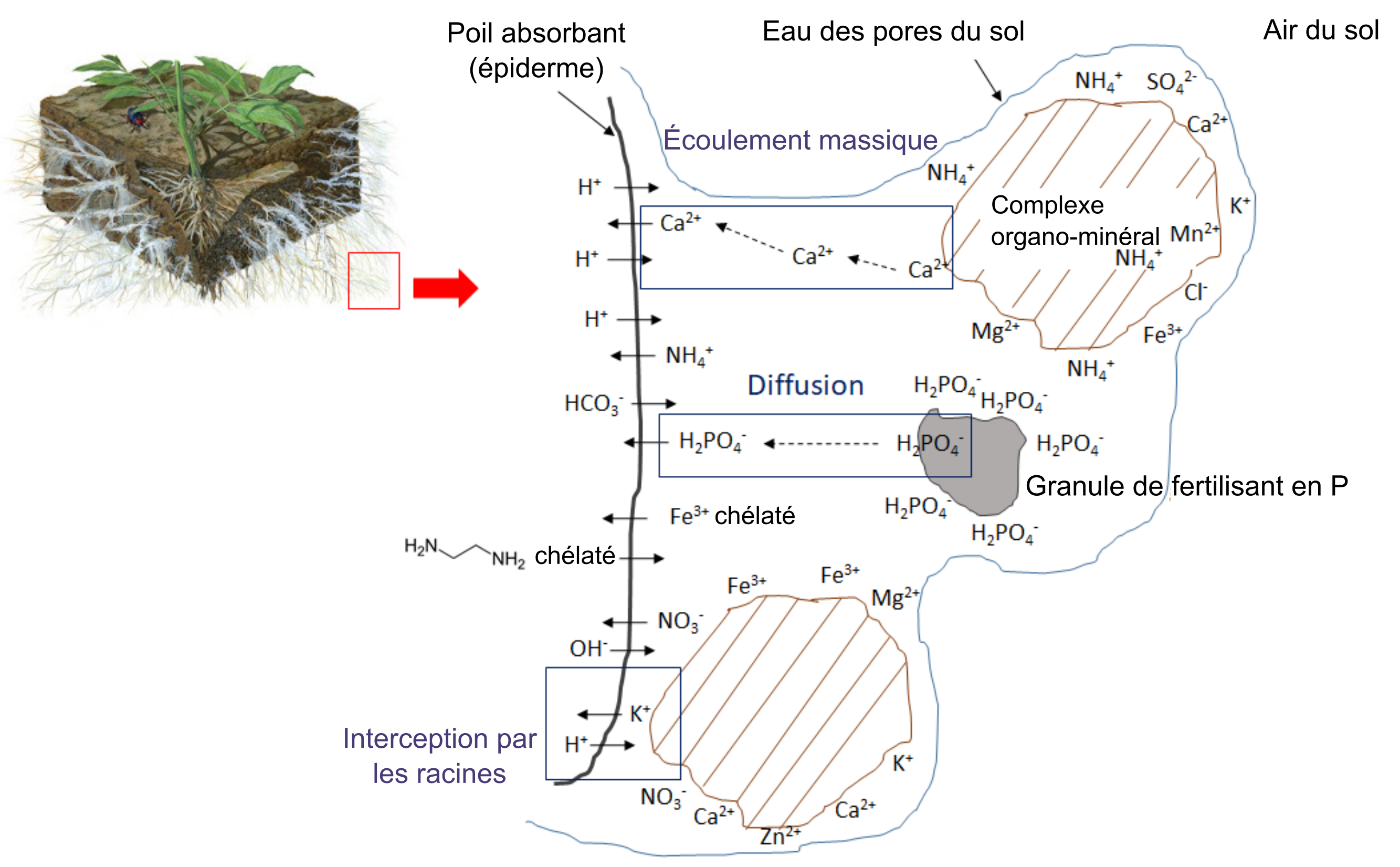
L’absorption d’ions nutritifs par les plantes diminue leur concentration dans le sol. Les ions peuvent se déplacer avec l’eau par écoulement massique ou être interceptés par des racines en croissance qui entrent en contact avec des ions échangeables sur les surfaces organominérales, un processus appelé interception par les racines (figure 7.1). Les ions peuvent également traverser des gradients de diffusion d’une zone de forte concentration à une zone de faible concentration dans l’eau interstitielle proche de la racine (figure 7.1). La concentration d’ions nutritifs dans l’eau interstitielle du sol est également affectée par de multiples processus biologiques, chimiques et physiques simultanés, tels que l’illustre la figure 7.2.
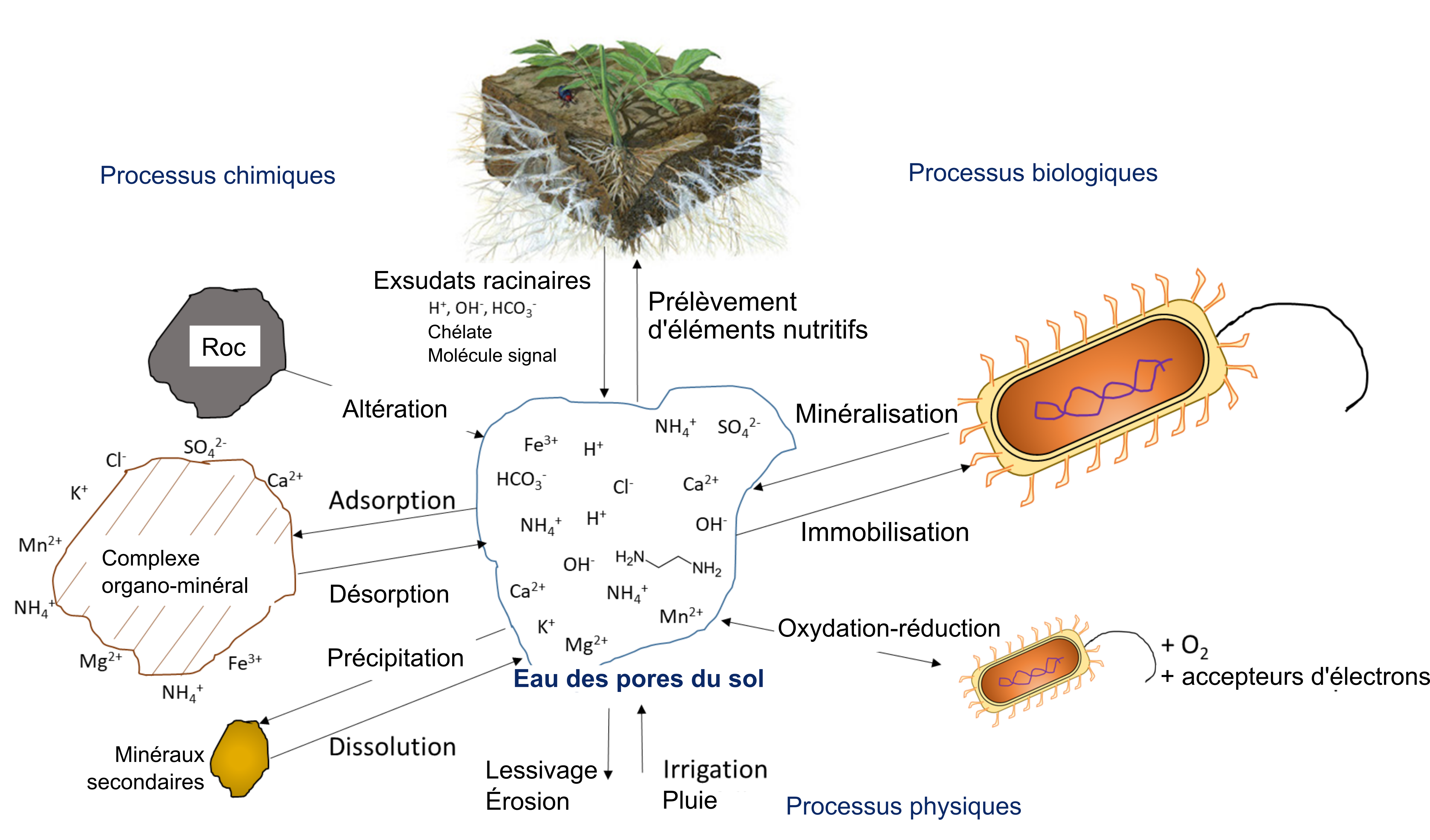
L’activité biologique se charge de minéraliser des composés organiques, libérant ainsi des ions nutritifs hydrosolubles. Dans le processus de minéralisation, les racines des plantes ou les microorganismes du sol produisent une enzyme hydrolytique spécifique qui leur permet de briser les liaisons covalentes dans un composé organique. Ces enzymes fonctionnent en présence d’eau, souvent en dehors des cellules biologiques. L’immobilisation définit le phénomène d’absorption des ions nutritifs qui concerne les organismes autres que les plantes. Les ions peuvent demeurer immobilisés dans la biomasse microbienne du sol pendant toute la période que dure le développement et la reproduction des microorganismes, soit de quelques jours à quelques semaines. Les ions se retrouvent remis en solution après la mort des microorganismes. Le concept de minéralisation-immobilisation-renouvellement s’applique à tout élément nutritif lié de manière covalente à la matière organique, notamment le carbone, l’azote, le phosphore et le soufre. La figure 7.3 illustre ce concept; les microorganismes produisent des enzymes qui hydrolysent les protéines, ce qui a pour effet de libérer du NH4+ dans l’eau interstitielle du sol; le NH4+ est ensuite immobilisé à l’intérieur des cellules microbiennes en croissance, puis finalement libéré de nouveau dans l’eau interstitielle du sol lors de la lyse de ces dernières.
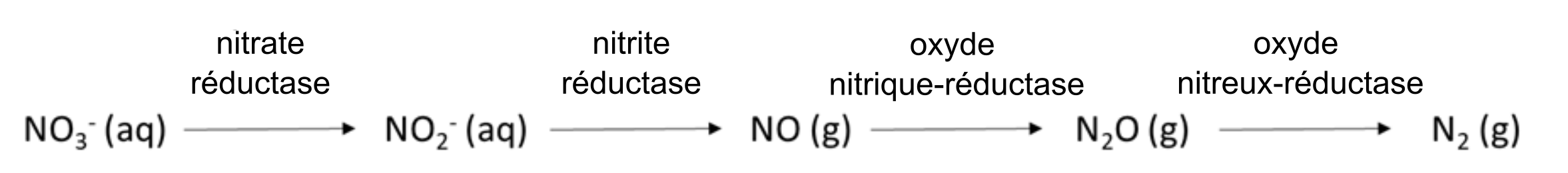
La concentration d’oxygène dans l’eau interstitielle du sol affecte la transformation des ions nutritifs. L’oxygène se déplace environ 1 000 fois plus rapidement à travers un pore rempli d’air que dans un pore rempli d’eau; il n’est donc pas rare qu’une limitation de l’oxygène se produise dans l’eau interstitielle du sol. La disponibilité limitée en oxygène peut stimuler la dénitrification, une réaction biologique au cours de laquelle les accepteurs d’électrons d’azote gagnent des électrons et diminuent ainsi leur état d’oxydation, par exemple :
NO3–(aq) → NO2–(aq) → NOx(g) → N2O (g) → N2(g)
qui change par le fait même la forme chimique de l’azote du NO3– hydrosoluble en gaz d’azote diatomique (N2). La réduction chimique d’éléments, tels que le Mn, le Fe et le sulfate dans un sol anoxique (à faible teneur en oxygène), est un autre processus qui modifie la spéciation chimique et les quantités de ces ions nutritifs dans l’eau interstitielle du sol.
Les réactions chimiques qui ajoutent des ions nutritifs à l’eau interstitielle du sol comprennent entre autres l’altération, qui se produit si une surface du minéral est exposée à des composés acides tels que l’acide carbonique. La dissolution définit le phénomène de solubilisation des ions nutritifs des argiles et des matériaux colloïdaux en présence d’eau. Dans un sol sec, la dissolution est réduite en raison de l’amoindrissement du volume d’eau interstitielle qui facilite le rapprochement des ions nutritifs, des ions réactifs et des molécules qui peuvent alors former des précipités. Les réactions dites de complexation qui ont lieu sur les surfaces organominérales peuvent soit augmenter la concentration d’ions nutritifs par des réactions de désorption, soit retirer des ions de la solution du sol par des réactions d’adsorption.
La concentration en ions nutritifs dépend fortement de la teneur en eau dans les pores du sol. L’irrigation et les précipitations ajoutent de l’eau dans les pores du sol, diluant ainsi les ions nutritifs hydrosolubles. Dans les régions humides qui ont plus de précipitations que d’évapotranspiration, les pores du sol peuvent périodiquement atteindre leur capacité maximale (100 %) de contenu en eau. Cela a pour effet de limiter la diffusion de l’oxygène et par le fait même les réactions d’oxydoréduction; la croissance de la plupart des plantes s’en trouve entravée, à l’exception de celles ayant subi des adaptations morphologiques qui leur permettent de tolérer l’inondation. Les activités agricoles se déroulent généralement sur des terres qui sont déjà naturellement bien drainées ou drainées artificiellement à dessein de favoriser le mouvement de l’eau sous la couche arable cultivable. Le drainage élimine l’eau, mais il entraîne également avec elle les ions nutritifs solubles hors du profil de sol. L’évacuation de l’excès d’eau de la couche arable par drainage ou par évaporation augmentera la concentration relative d’ions solubles demeurés dans l’eau interstitielle du sol.
FERTILITÉ DU SOL ET NUTRITION DES PLANTES
Les plantes acquièrent la plupart de leurs ions nutritifs essentiels à partir de l’environnement dynamique que constitue l’eau interstitielle du sol. En agriculture, beaucoup d’efforts sont déployés pour comprendre le phénomène d’apport du sol en éléments nutritifs. Tel sol contiendra-t-il suffisamment d’éléments nutritifs pour répondre aux besoins de telle ou telle plante ou devra-t-on ajouter des engrais pour pallier une carence ?
Les tests de fertilité du sol constituent un moyen précis d’évaluer la teneur des sols agricoles en éléments nutritifs. L’objectif principal de ces tests est de déterminer si un sol contient suffisamment d’éléments nutritifs pour répondre aux besoins d’une culture annuelle donnée pendant toute sa vie (une saison de croissance). En outre, ces tests peuvent servir à déterminer s’il existe un apport suffisant d’éléments nutritifs dans le cas des cultures pérennes pendant leurs phases d’établissement et de production qui s’étendent sur plusieurs saisons de croissance. Les tests de fertilité des sols reposent sur des analyses chimiques et biologiques effectuées par des laboratoires certifiés. Les résultats de ces tests font de bons indicateurs de l’apport d’éléments nutritifs assimilables par une plante donnée. Cette affirmation repose sur deux observations factuelles. Première observation : la plante va acquérir des ions nutritifs de l’eau interstitielle du sol en fonction de ses besoins en éléments nutritifs tout au long de sa saison de croissance. Deuxième observation : l’eau interstitielle du sol sera réapprovisionnée en ions nutritifs solubles à un taux qui reflète l’activité combinée des processus biologiques, chimiques et physiques, processus qui augmentent ou réduisent les concentrations d’ions de l’eau interstitielle du sol pendant la saison de croissance. Pour cette raison, les méthodes d’analyse du sol, telles que l’extraction Mehlich 3, retirent les ions nutritifs de l’eau interstitielle du sol et d’autres sources (figure 7.4), ce qui donne une bonne approximation de l’apport en éléments nutritifs qui deviendront disponibles pour les plantes pendant la saison de croissance.
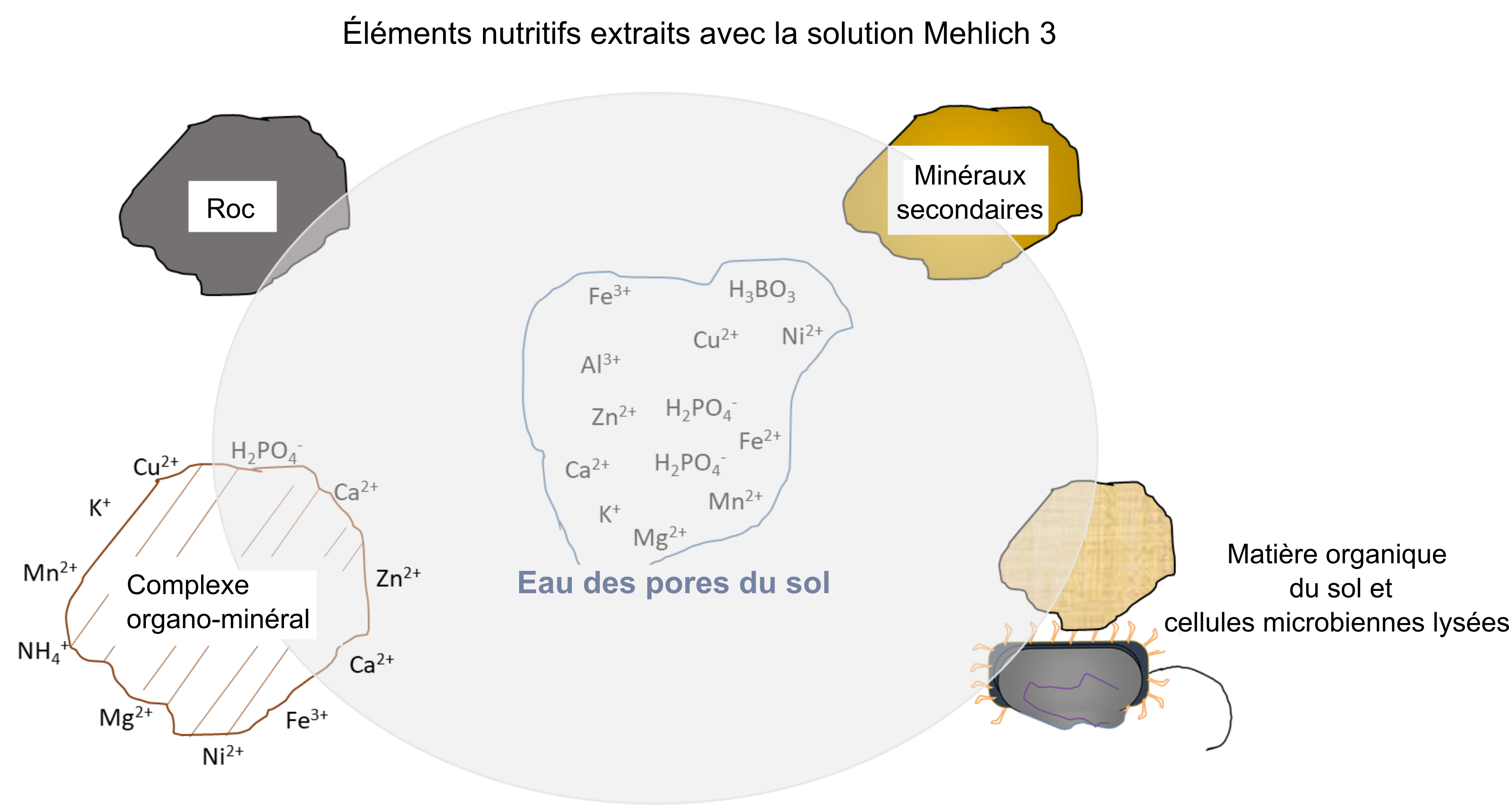
Un autre objectif des tests de fertilité des sols est d’évaluer la probabilité d’obtenir une réaction favorable d’une culture donnée à l’apport d’engrais et d’amendements dans le sol. Une telle évaluation s’inscrit dans un plan intégré d’amélioration des conditions de croissance des cultures. Les producteurs fixent des objectifs de rendement de leurs cultures en fonction des objectifs de production et de rentabilité qu’ils espèrent atteindre. Le rendement maximal que l’on peut attendre d’une plante cultivée donnée (une céréalière, une oléagineuse, un tubercule, etc.) dépend de ses caractéristiques génétiques et physiologiques, car elles régissent sa capacité photosynthétique, sa capacité à acquérir l’eau et les éléments nutritifs du sol et sa capacité à convertir l’ensemble de ces ressources en produits commercialisables (céréales, oléagineux, tubercules amylacés, fruits, etc.). De plus, le rendement maximum est influencé par la réaction de la culture d’une plante donnée aux conditions environnementales pendant sa saison de croissance. Par exemple, des conditions météorologiques défavorables peuvent fournir trop ou trop peu de précipitations pour une culture donnée. Le stress thermique résultant de températures trop chaudes pendant les mois d’été, ou des dommages causés par le gel au printemps et à l’automne, sont des sources de stress pour les cultures en général. Les producteurs adoptent généralement les pratiques agronomiques qui permettent d’agir sur les facteurs qui limitent la croissance. Prenons le facteur « espacement entre les plantes » : il doit être optimisé pour qu’elles puissent intercepter tout le rayonnement solaire disponible; un espacement trop étroit les mènerait à se faire concurrence, ce qui n’est pas souhaitable. Parmi d’autres facteurs auxquels les producteurs doivent faire face, on compte les mauvaises herbes, les ravageurs et les organismes pathogènes. Ils sont tous des causes de pertes de rendement. Enfin, tout bon producteur sait à quel point un sol doit pouvoir fournir les bons éléments nutritifs au bon moment pendant tout le développement de la culture s’il veut atteindre le rendement et la qualité prévus.
Matière à réflexion !
Quand le bleuet devient sauvage grâce à l’engrais azoté
La disponibilité de l’azote (N) dans la solution du sol limite la croissance des plantes et le rendement des cultures dans la plupart des agroécosystèmes. Voilà pourquoi les agriculteurs fertilisent souvent leurs champs avec une ou plusieurs formes de N. Néanmoins, l’efficacité de la fertilisation azotée dépend de plusieurs facteurs – notamment la présence de mauvaises herbes – qui peuvent concurrencer la plante cultivée pour l’acquisition de l’azote qui provient des engrais.
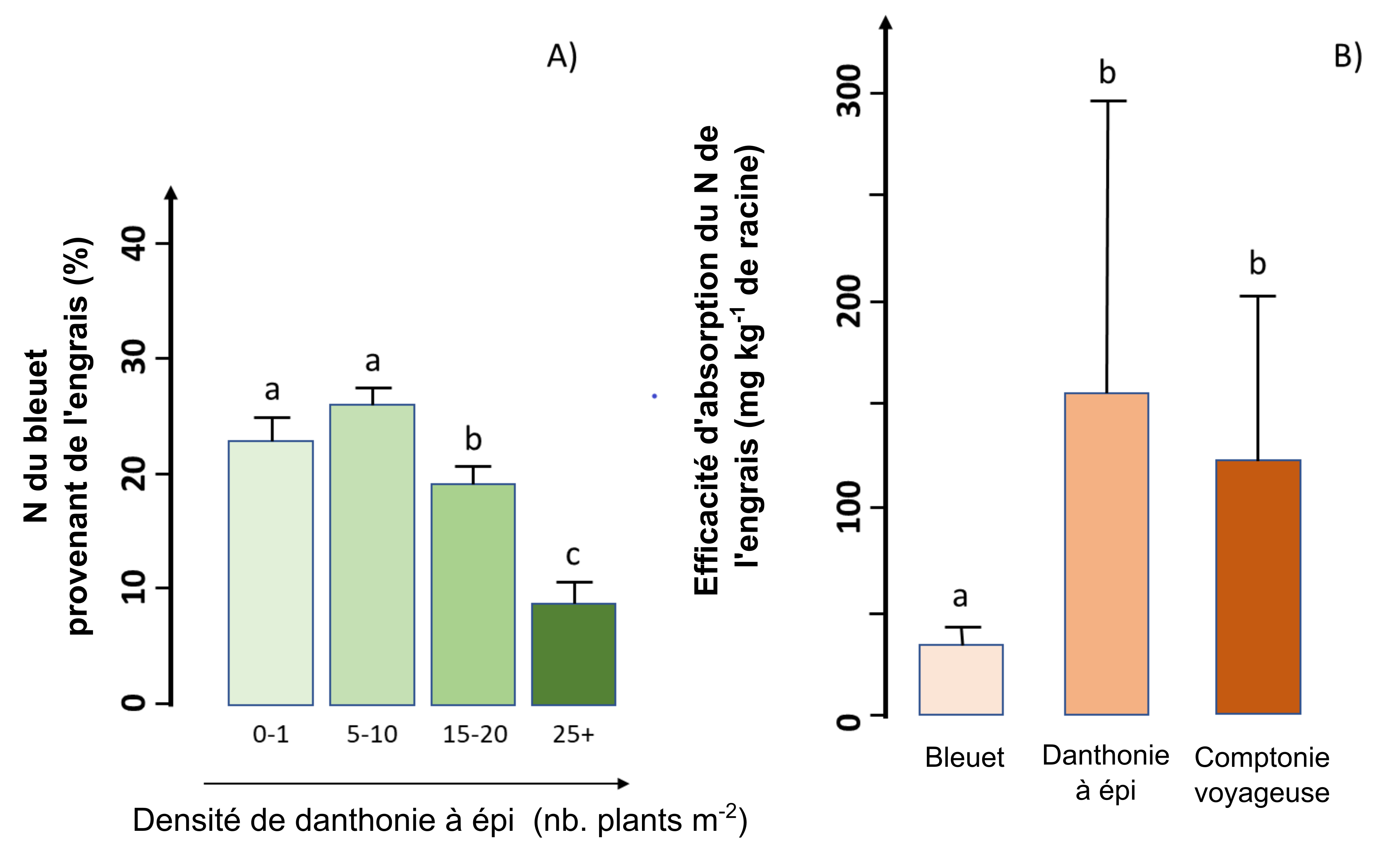
Des chercheurs ont mené une étude dans un champ commercial de bleuets nains (Vaccinium angustifolium Aiton) dans la région du Lac Saint-Jean, Québec, Canada, pour évaluer l’efficacité de la fertilisation azotée en présence de deux espèces de mauvaises herbes communes (la danthonie à épi et la comptonie voyageuse). Les chercheurs ont découvert que la production de biomasse aérienne et la quantité d’azote associée étaient beaucoup plus élevées chez le bleuet que chez les deux espèces de mauvaises herbes, ce qui indique que le bleuet a capté la majeure partie de l’engrais azoté ajouté. Cependant, la croissance des bleuets et l’absorption d’engrais ont diminué avec l’augmentation de la densité de mauvaises herbes (figure A). Dans le cas où la densité de la danthonie dépassait 15 plants m-2, elle a capté la même quantité d’engrais que les bleuets, malgré sa biomasse souterraine beaucoup plus petite, ce qui finalement n’a pas créé d’impact négatif significatif sur la production de bleuets. De plus, les chercheurs ont découvert que l’efficacité d’absorption d’engrais (l’absorption d’engrais par gramme de racine) était environ quatre fois plus faible chez les bleuets que chez les deux espèces de mauvaises herbes (figure B). En d’autres termes, par rapport aux mauvaises herbes, le bleuet nécessite quatre fois plus de biomasse souterraine que les mauvaises herbes pour acquérir la même quantité d’azote à partir d’engrais. La version complète de ce texte est décrite dans Marty et al. (2019).
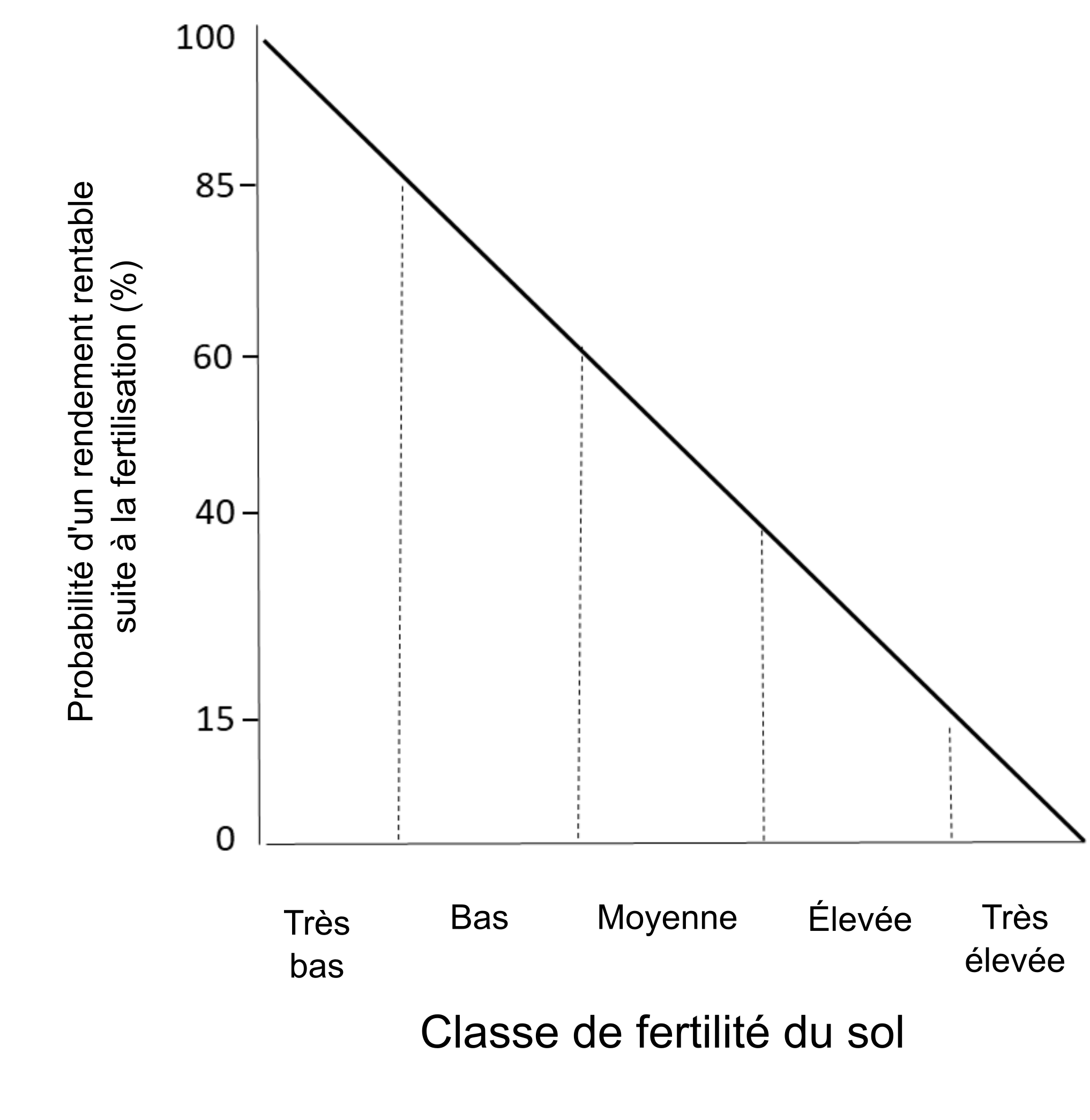
Étant donné que les tests de fertilité du sol quantifient les concentrations en éléments nutritifs disponibles pour les plantes, ils peuvent donc servir à interpréter la réaction des cultures aux apports d’éléments nutritifs. Ces tests doivent être accompagnés de mesures de la réaction des cultures aux apports d’éléments nutritifs qui auront été effectuées dans un milieu qu’il est possible de « contrôler » : une chambre de croissance, une serre et une expérience au champ. Dans les sols dont l’apport nutritif va de faible à moyen, la croissance d’une culture sera probablement améliorée par l’ajout d’engrais. En revanche, une culture mise en production dans un sol allant d’une fertilité élevée à excessivement élevée bénéficie rarement de l’application d’engrais (figure 7.5). Étant donné que l’utilisation d’engrais est onéreuse autant en termes d’achat, de transport que d’application au champ, l’investissement n’est pas rentable si aucune amélioration de rendement n’est attendue.
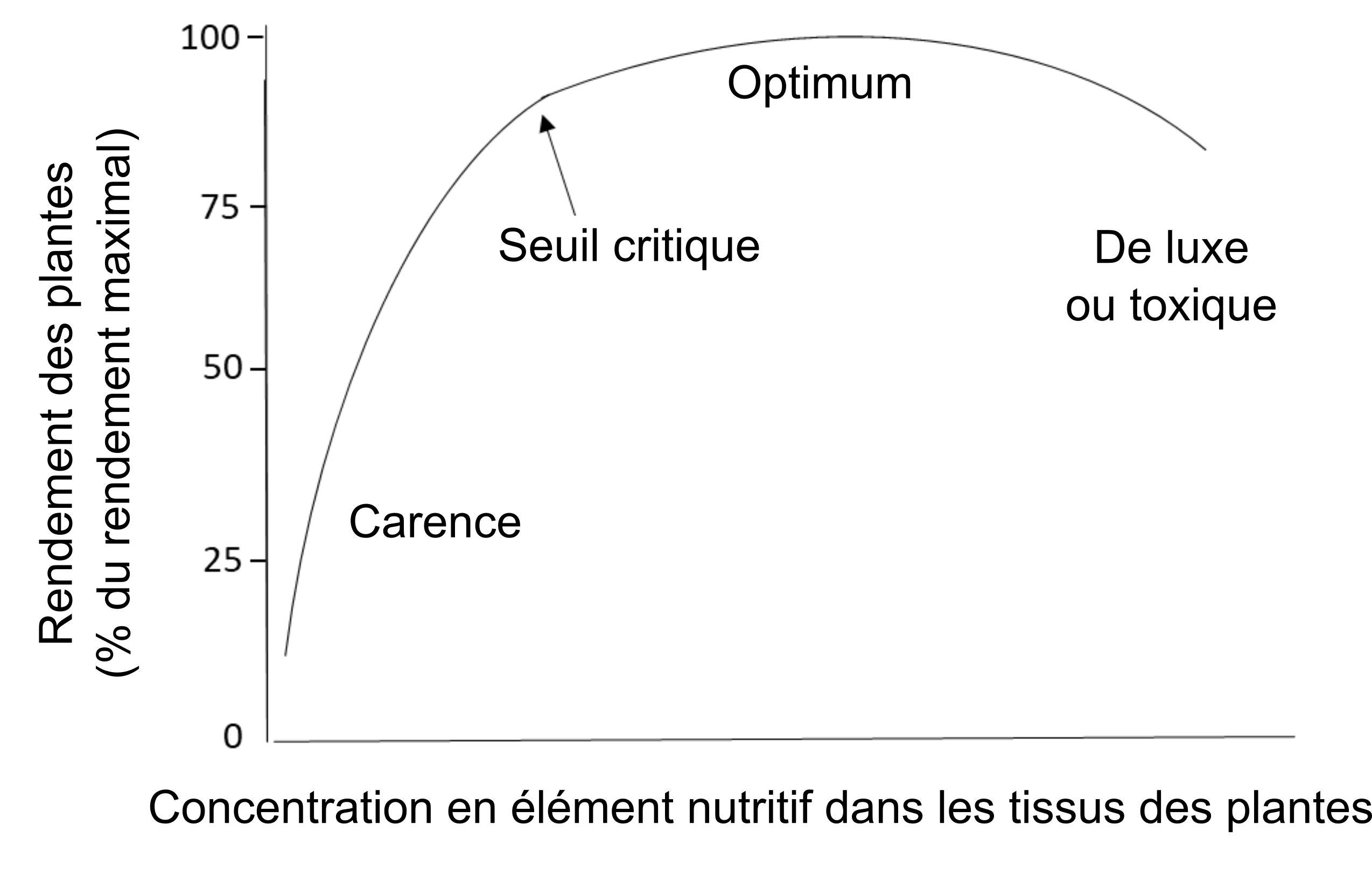
Les besoins nutritifs d’une plante donnée sont déterminés en mesurant sa teneur en éléments nutritifs, soit dans un tissu spécifique, soit dans la plante entière. Lorsqu’une plante donnée reçoit suffisamment d’éléments nutritifs – qui proviennent du sol ou de l’engrais – sa concentration en éléments nutritifs se situe dans l’étendue de ses besoins allant de suffisant à optimal. Si l’apport en éléments nutritifs du sol est insuffisant et qu’aucun engrais n’est appliqué, la plante deviendra déficiente en cet élément. À l’inverse, une plante qui accumule plus d’éléments nutritifs qu’elle en a besoin pour le déroulement de ses processus métaboliques pourrait présenter une teneur en éléments nutritifs excessivement élevée ou toxique (figure 6). La toxicité des éléments nutritifs est rare dans le cas des macronutriments tels que N, P, K, Ca, Mg et S, car les processus actifs de transport qui transfèrent les ions nutritifs hydrosolubles à travers l’endoderme et dans le xylème d’une plante donnée sont étroitement régulés par les gènes. Il y a danger de toxicité des oligo-éléments tels que B, Fe, Mn, Zn et Cu si appliqués sur les feuilles d’une plante à des taux suffisamment élevés pour endommager ses cellules photosynthétiques sensibles. Cependant, le système racinaire des plantes en général peut absorber ces oligo-éléments sans danger, car elles possèdent des mécanismes de défense qui gouvernent non seulement l’absorption, l’accumulation et la translocation des oligo-éléments, mais aussi d’autres métaux. Les ions des oligo-éléments se trouvent retenus dans les cellules des racines où ils sont détoxifiés par complexation avec des acides aminés, des acides organiques ou des peptides, par formation d’un lien avec ces métaux ou par séquestration dans des vacuoles. Ces mécanismes empêcheront la translocation des oligo-éléments vers les tissus foliaires sensibles.
Les besoins en éléments nutritifs des cultures agricoles sont connus. Les cultures qui n’ont pas la quantité d’éléments nutritifs suffisante pour leur plein développement ne pousseront pas normalement, deviendront rabougries et pourront présenter des symptômes de carence, tels que la chlorose (jaunissement des feuilles). La chlorose peut indiquer une carence d’un des éléments nutritifs qu’une plante utilise pour produire la chlorophylle, ce pigment vert des feuilles qui joue un rôle essentiel dans la photosynthèse. Même s’il n’y a pas de symptômes visibles de carence en éléments nutritifs, la nutrition inadéquate d’une plante peut générer d’autres effets indésirables :
- l’affaiblissement de sa tige, la rendant vulnérable à la verse pendant une tempête de vent, de grêle ou d’une pluie torrentielle;
- la production moindre de fleurs ou d’inflorescences;
- l’avortement des graines;
- la mauvaise qualité des graines (teneur faible en protéines, manque d’acides aminés essentiels, teneur faible en lipides);
- la perte de rendement commercialisable – production insuffisante de fruits, graines, tubercules ou qui sont de trop petite taille.
La meilleure façon de savoir si c’est le manque d’éléments nutritifs qui limite la croissance des cultures est d’analyser les tissus végétaux d’un échantillon représentatif de plante d’une espèce donnée. Cela implique de prélever un échantillon de la plante à un stade de croissance approprié, généralement pendant la croissance végétative ou au début du stade de reproduction. Les échantillons sont envoyés à un laboratoire d’analyse certifié; les résultats sont interprétés à l’aide de tableaux de référence qui présentent les teneurs suffisantes de macro- et micronutriments dans la culture d’une plante donnée (tableau 7.3). Étant donné que chaque stade de croissance d’une plante d’une culture donnée a des besoins nutritionnels spécifiques, le tableau de référence doit être tout aussi spécifique à l’espèce de plante en culture. En général, on procède à l’analyse des tissus de la plante cultivée au début de sa saison de croissance au cas où les résultats révéleraient la présence d’une carence d’un ou de plus d’un élément nutritif, carence qui pourrait dès lors être prévenue ou corrigée par l’application d’engrais. Analyser au bon moment les tissus de la plante en culture peut guider l’agriculteur dans le choix d’un ou de plus d’un élément nutritif à appliquer en cours de saison, lui évitant ainsi des pertes de rendement potentiel. Par ailleurs, la confirmation tardive d’un diagnostic de carence résultant d’une analyse de tissu peut faire échouer toute tentative d’application de mesures correctives. Par exemple, tenter d’épandre de l’engrais dans un champ où la plante cultivée est déjà rendue trop haute pour que la machinerie puisse y entrer. Par exemple, tenter de corriger une carence d’un élément non mobile dans la plante à un moment où elle ne pourra plus rattraper le retard de croissance que lui aura causée cette carence. Par conséquent, les tests de fertilité du sol sont préférables aux analyses des tissus végétaux, car ils permettent d’éviter les pertes de rendement attribuables aux carences nutritionnelles dont une culture peut souffrir au cours de sa saison de croissance.
Tableau 7.3 Gamme de concentrations satisfaisantes en macro- et des oligo-éléments dans les plants de maïs en fonction des stades de croissance (d’après Jones, 2003)
| Élément | Stade V4-V6 (30 cm de hauteur) |
Stade V10 (avant la floraison mâleg) |
Stade R1 (apparition des soies) |
|---|---|---|---|
| Azote (%) | 3.50-5.00 | 3.00-5.00 | 2.70-4.00 |
| Phosphore (%) | 0.30-0.50 | 0.25-0.45 | 0.25-0.50 |
| Potassium (%) | 2.50-4.00 | 2.00-2.50 | 1.70-3.00 |
| Calcium (%) | 0.30-0.70 | 0.25-0.50 | 0.21-1.00 |
| Magnésium (%) | 0.15-0.45 | 0.13-0.30 | 0.20-1.00 |
| Soufre (%) | 0.15-0.50 | 0.15-0.50 | 0.21-0.50 |
| Bore (mg kg-1) | 5-25 | 4-25 | 5-25 |
| Cuivre (mg kg-1) | 5-20 | 3-15 | 6-20 |
| Fer (mg kg-1) | 50-250 | 10-100 | 20-250 |
| Manganèse (mg kg-1) | 20-300 | 15-300 | 20-200 |
| Molybdène (mg kg-1) | 0.10-0.30 | 0.10-0.30 | 0.10-0.20 |
| Zinc (mg kg-1) | 20-60 | 15-60 | 25-100 |
NGRAIS ET AMENDEMENTS DU SOL
On appelle engrais tout matériel qui fournit des ions nutritifs hydrosolubles à une culture agricole donnée. Les plantes absorbent les ions nutritifs de l’eau interstitielle du sol, sans montrer ni préférence ni discrimination entre les sources d’engrais. Par conséquent, tout engrais qui libère des ions nutritifs solubles dans l’eau pourrait être bénéfique pour une plante donnée. Les caractéristiques de certains engrais qui peuvent augmenter l’apport en NH4+ et en NO3- dans le sol sont présentées au tableau 7.4.
Tableau 7.4 Caractéristiques de certains engrais azotés pouvant fournir du NH4+ et du NOsub>3- aux cultures, d’après IPNI (2012) et Munroe (2016)
| Engrais | Analyse garantie1 | Commentaires |
|---|---|---|
| Ammoniac anhydre | 82-0-0 | Appliqué sous forme de gaz comprimé; nécessite un équipement spécial et une formation |
| Nitrate d’ammonium et de calcium | 27.5-0-0 | Granulaire; soluble dans l’eau |
| Sulfate d’ammonium | 21-0-0 + 24% soufre |
Granulaire; soluble dans l’eau |
| Urée | 46-0-0 | Granulaire; soluble dans l’eau ydrolysé par les enzymes uréases pour libérer du NH4+ |
| Engrais à base de nitrate d’ammonium et d’urée | 28-0-0 | Mélange contenant 50 % d’urée et 50 % de nitrate d’ammonium |
| Analyse représentative2 | ||
| Lisier de porc liquide | 2.2-2.7-1.9 | Solution (>90% water) with C:N ratio <5 |
| Déchets de laiterie | 1.2-1.8-2.9 | Solution (>90 % d’eau) avec un rapport C:N ratio <10 |
| Fumier de poulet | 2.4-1.1-1.0 | Solide décomposé, rapport C:N <20 |
| Fumier de bovins de boucherie | 0.8-1.8-2.6 | Solide partiellement décomposé, rapport C:N <25 |
| 1L’analyse garantie est basée sur le %N - %P2O5-%K2O dans l’engrais, sur une base de poids sec. 2L’analyse représentative du fumier est basée sur le %N - %P2O5-%K2O, sur une base de poids humide. |
||
Les sources d’engrais peuvent être classés en fonction de leur mode de fabrication, mais du point de vue de la nutrition des plantes, il est plus intéressant de considérer à quelle vitesse les ions nutritifs hydrosolubles se libèrent dans l’eau interstitielle du sol. Par exemple, du phosphate de monoammonium granulaire fabriqué par un producteur d’engrais se dissout dans l’eau du sol, libérant les ions NH4+ et H2PO4– solubles. Un autre engrais solide, mais naturel, le fumier de poulet, contient environ 4 % d’azote total et 0,5 % de phosphore total (équivalent à 1.1 % de P2O5). L’azote total est composé d’acide urique, de protéines et de NH4+; le phosphore total contient des composés d’orthophosphates (50-75 % du P total) et des composés organiques du phosphore, tels que le myo-inositol (25-50 % du P total). Parce que le poulet ne produit pas d’enzymes phosphatases dans son tube digestif, il n’absorbe que de 10 à 30 % du phosphore organique qui se trouve dans sa nourriture, le reste se retrouve dans ses excréments. Lorsque du fumier de poulet est appliqué sur un sol, les composés organiques du phosphore se dissolvent dans l’eau du sol puis ils sont dégradés par les enzymes phosphatases produites par les racines des plantes et les microorganismes du sol. L’enzyme phosphatase hydrolyse le phosphore organique pour libérer des ions phosphate (H2PO4–) dans l’eau interstitielle du sol (figure 7.7). Le phosphate de monoammonium granulaire se dissout généralement plus rapidement que ne peut le faire l’hydrolyse des composés organiques du phosphore dans le fumier de poulet. C’est pourquoi les engrais à base de sels sont qualifiés d’engrais dits à « libération rapide », tandis que les fumiers sont considérés comme des engrais à « libération lente ».
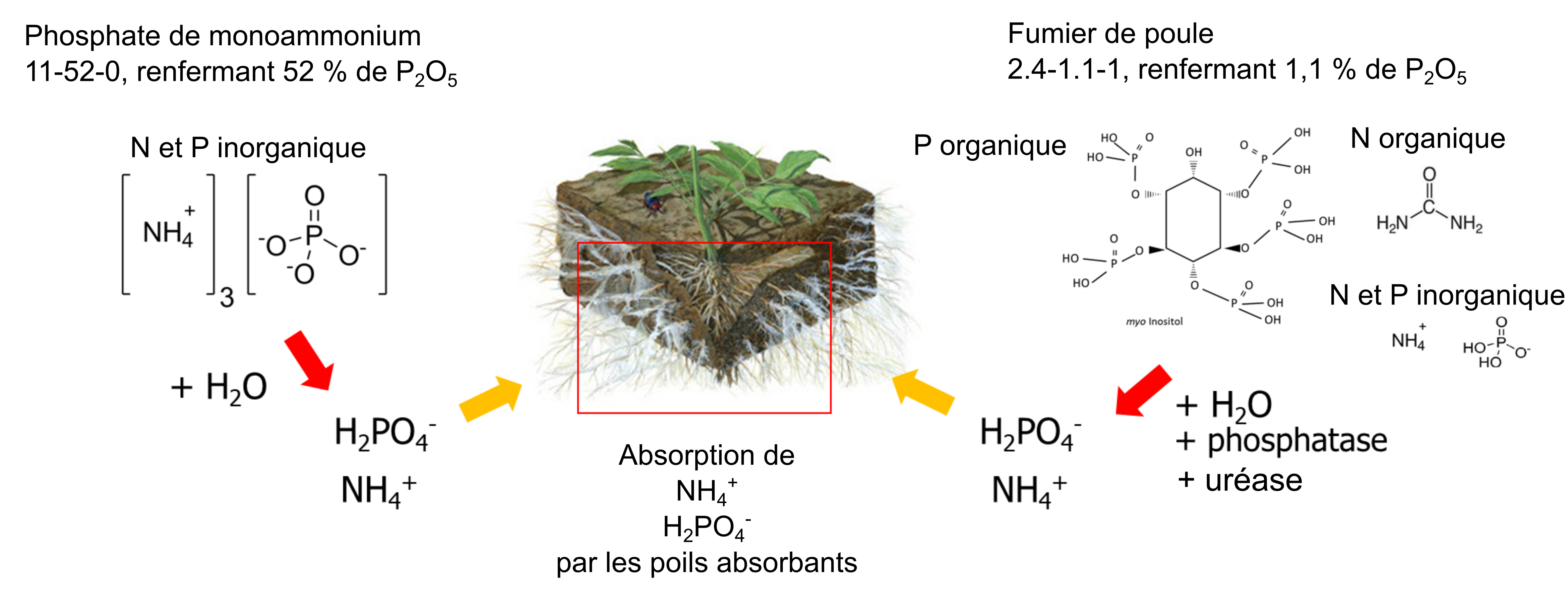
On entend par amendement de sol tout ajout de matériel susceptible d’améliorer l’état du sol, et non nécessairement qu’il fournisse les éléments nutritifs pour la croissance d’une plante donnée. Par exemple, on appliquera souvent de la chaux moulue sur un sol acide en vue d’augmenter le pH et de réduire la concentration d’Al3+ et de Mn2+ dans l’eau interstitielle du sol, car ces éléments peuvent causer des dommages aux racines des cultures. La neutralisation du sol à un pH d’environ 6.0 à 7.0 fournit plus de NH4+, de H2PO4– et de K+ solubles en plus d’augmenter l’activité des bactéries du sol, deux effets bénéfiques pour la croissance des plantes et le maintien de la structure du sol. Le paillis et le biochar sont deux autres types d’amendement de sol. Ces matériaux riches en carbone ne constituent pas une source substantielle d’éléments nutritifs disponibles pour les plantes, mais ils contiennent de la matière organique qui peut retenir l’humidité du sol et les ions échangeables, améliorer la structure du sol et fournir un substrat à divers microorganismes hétérotrophes. Étant donné que les types d’amendements riches en carbone stimulent la croissance des microorganismes, on doit les utiliser avec parcimonie pour éviter que des microorganismes à croissance rapide n’immobilisent les ions nutritifs de l’eau interstitielle du sol, privant ainsi les plantes d’éléments nutritifs.
CYCLE DES ÉLÉMENTS NUTRITIFS DU SOL
Les cultures agricoles absorbent les ions nutritifs de l’eau interstitielle du sol et produisent de la biomasse autant comestible (par ex. céréales, oléagineux, fourrage, fruits et tubercules) que non comestible, laquelle est parfois récoltée pour servir de litière aux animaux ou à d’autres fins (par ex. les biocarburants de seconde génération sont fabriqués à partir de tiges et de feuilles non comestibles). L’ajout d’engrais permettra de reconstituer les réserves d’éléments nutritifs disponibles pour les plantes, mais les ions nutritifs des engrais ne resteront pas nécessairement dans l’eau interstitielle du sol, car ils seront soumis à toutes les réactions de nature biologique, chimique et physique qui font partie du cycle des éléments nutritifs du sol comme décrit ci-dessous.
Cycle de l’azote
Réactions qui contribuent à la disponibilité de l’azote pour les plantes
Le cycle de l’azote du sol (figure 7.8) est bien connu, en raison du rôle central que cet élément nutritif joue dans la production de la chlorophylle et dans les réactions du cycle de Calvin qui ont lieu dans les chloroplastes lors de la photosynthèse et de la synthèse des protéines chez les plantes. Les cultures agricoles peuvent obtenir de l’azote grâce aux relations symbiotiques ou associatives qu’elles entretiennent avec des procaryotes fixateurs de N2. Les plus connues d’entre eux sont les bactéries du sol du genre Rhizobium, mais il en existe de nombreuses autres (tableau 7.5). Les procaryotes fixateurs de N2 possèdent l’enzyme nitrogénase, capable de transformer le N2 atmosphérique en ammoniac (NH3), un précurseur de la synthèse des protéines, par la réaction suivante :
Le complexe nitrogénase réduit le N2 en NH3 et réduit également le H+ en H2. L’énergie (ATP) de cette réaction provient de la dégradation par glycolyse des produits de la photosynthèse que la plante hôte transfère au symbiote. Le produit NH3 (g) diffuse hors du protoplasme de la bactérie dans le cortex racinaire où il est protoné avec 2 ions H+ sans recours à de l’énergie supplémentaire, pour donner :
Le NH4+ se lie alors au glutamate pour produire de la glutamine, ou bien il se transforme en uréides, tels que l’allantoïne, l’acide allantoïque ou la citrulline, avant d’être transféré de la racine vers d’autres parties de la plante.
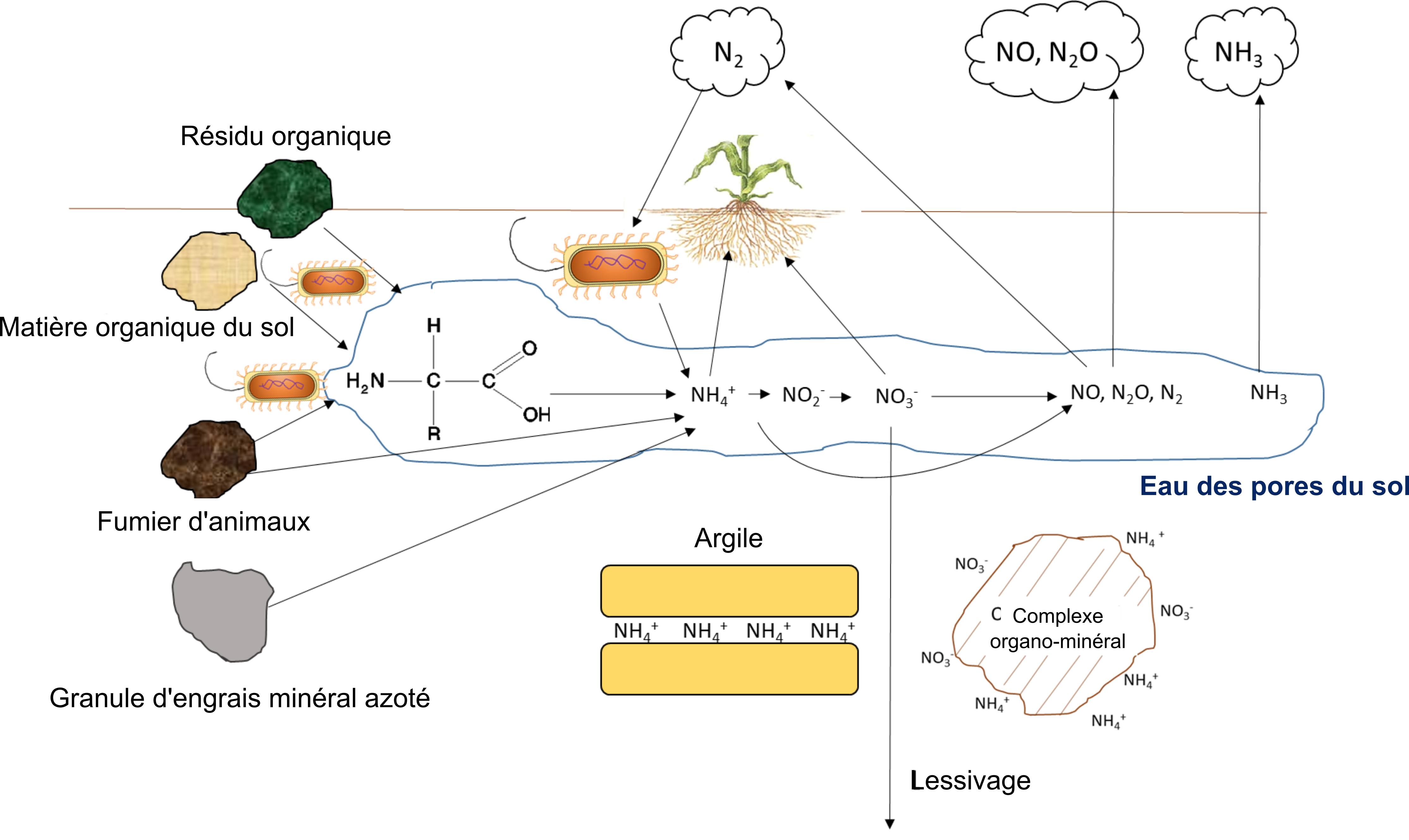
Les légumineuses de la famille des Fabacées forment une association symbiotique avec les bactéries fixatrices d’azote, habituellement du genre Rhizobium. L’association se concrétise dans la formation de nodosités sur les racines des légumineuses. Le processus de formation de l’association symbiotique commence par la sécrétion de flavonoïdes par les racines de la légumineuse, dont les propriétés chimioattractives attirent les bactéries fixatrices d’azote symbiotiques, qui viennent alors s’attacher aux poils absorbants des racines. Cette sécrétion déclenche chez ces bactéries rhizobiennes l’activation des gènes qui synthétisent les facteurs de nodulation chargés de former le lien avec les récepteurs protéiques de surface à l’extrémité subapicale des racines. Ce processus fait boucler les poils absorbants racinaires qui se trouvent à emprisonner les bactéries; la membrane plasmique des poils s’invagine ensuite pour former le fil d’infection, soit la structure tubulaire qui s’étend de la pointe des poils absorbants aux cellules inférieures du cortex racinaire. Les bactéries se déplacent à travers le fil d’infection et se multiplient; les cellules du cortex racinaire prolifèrent aussi dans le primordium nodulaire, l’ensemble finissant par former des nodules entiers, enveloppés dans une membrane. Le rôle de la membrane sera d’empêcher la diffusion de l’oxygène, capable de désactiver la nitrogénase. À ce stade du processus, les bactéries rhizobiennes deviennent des bactéroïdes capables de procéder à la fixation biologique du N2.
Bien que le N2 soit abondant (78 % de l’atmosphère terrestre), la réaction biologique de fixation du N2 demeure exigeante sur le plan énergétique. En théorie, il faut 16 ATP pour réduire une molécule de N2 en NH3 (g), mais le besoin réel en énergie est généralement plus élevé, en raison du caractère énergivore du processus de fixation lui-même. Par conséquent, la fixation biologique de N2 est un processus strictement contrôlé. Toutes les autres formes d’azote disponibles, telles que NH4+, NO3– et les acides aminés, inactiveront le complexe nitrogénase et inhiberont l’expression des gènes nif qui codent les composantes de la nitrogénase. De plus, les produits de réaction de NH3 (g) et de H2 inhibent également l’activité de la nitrogénase. Conséquemment, la plupart des légumineuses acquièrent de 40 à 75 % de leur besoin en azote grâce à la fixation biologique de N2 et acquièrent le reste en absorbant l’azote sous forme de NH4+ et de NO3– solubilisé dans l’eau des pores du sol.
Par ailleurs, une autre classe de bactéries fixatrices d’azote, les associatives, vivent dans la rhizosphère (dans les pores et sur les particules du sol proches des racines des plantes) ou en tant qu’endophytes (dans les tissus végétaux) des graminées, telles que la canne à sucre, le riz, le blé, le sorgho, le maïs et bien d’autres. Certains genres de ces bactéries sont communs, tels que les genres Azospirillum et Herbaspirillum, mais il y en a beaucoup d’autres (tableau 7.5). Ces bactéries ne forment pas de nodules. Au lieu de cela, elles vivent à la surface des racines ou dans l’espace intercellulaire et les vaisseaux du xylème des tiges et des feuilles. Elles tirent leur énergie de la photosynthèse des plantes, mais transfèrent en retour à la plante une partie du NH4+ qu’elles ont généré en fixant le N2. Leur contribution aux besoins en azote des cultures varie beaucoup. Dans la canne à sucre, Gluconacetobacter diazotrophicus peut fournir jusqu’à 60 % des besoins en azote dans les conditions au champ. Les céréales et les graines oléagineuses peuvent obtenir de 1 à 25 kg N ha-1 an-1 de leurs bactéries associatives fixatrices d’azote. Le reste de l’azote nécessaire à ces cultures doit être absorbé par l’eau interstitielle du sol sous forme d’ions NH4+ et NO3–.
Tableau 7.5 Procaryotes fixateurs d’azote qui peuvent fournir de l’azote aux plantes. Adapté de Rascio et La Rocca (2013)
| Classe | Procaryote fixateur de N2 | Plante-hôte |
|---|---|---|
| Symbiotique | Allorhizobium sp (croissance rapide) Azorhizobium sp (croissance rapide) Bradyrhizobium sp (croissance lente) Mesorhizobium sp (croissance intermédiaire) Rhizobium sp (croissance rapide) Sinorhizobium sp (croissance rapide) |
Légumineuses (famille des Fabacées) |
| Anabaena azollae (cyanobactéries) | Fougère aquatique (Azolla) | |
| Frankia sp (actinobactérie) | Arbustes ligneux, par ex., dans les familles des Betulacées, Casuarinacées et Myricacées | |
| Associative | Azospirillum sp Bacillus sp Beijerinckia fluminense Derxia sp Enterobacter sp Erwinia sp Gluconacetobacter diazotrophicus Herbaspirillum sp |
Céréales (famille des Poacées) Oléagineux (famille des Brassicacées) |
Matière à réflexion !
De l’importance d’évaluer l’apport du sol en azote : L’exemple de l’Île-du-Prince-Édouard
L’azote est un élément nutritif très dynamique et essentiel à la production agricole, mais susceptible d’avoir un impact environnemental important. D’où l’importance de recourir à l’azote aussi efficacement que possible. Toutefois, avant de procéder à l’ajout d’azote, encore faut-il tenir compte de ce que le sol fournit déjà. Dans les agroécosystèmes semi-arides et sub-humides, tels que ceux des Prairies canadiennes, l’azote des nitrates résiduels (NO3-N) constitue une importante source d’azote pour les cultures subséquentes, de sorte que cette source devrait être considérée dans l’analyse des tests de fertilité du sol de même que dans les recommandations de fertilisation. Dans les agroécosystèmes humides et frais, comme ceux dans l’Est canadien, la perte d’azote au cours de l’hiver est telle que le transfert de nitrate à la culture suivante s’en trouve limité (Zebarth et al. 2003). En conséquence, la minéralisation de l’azote pendant la saison de croissance constitue un facteur important d’intrant pour les cultures dans ces agroécosystèmes.
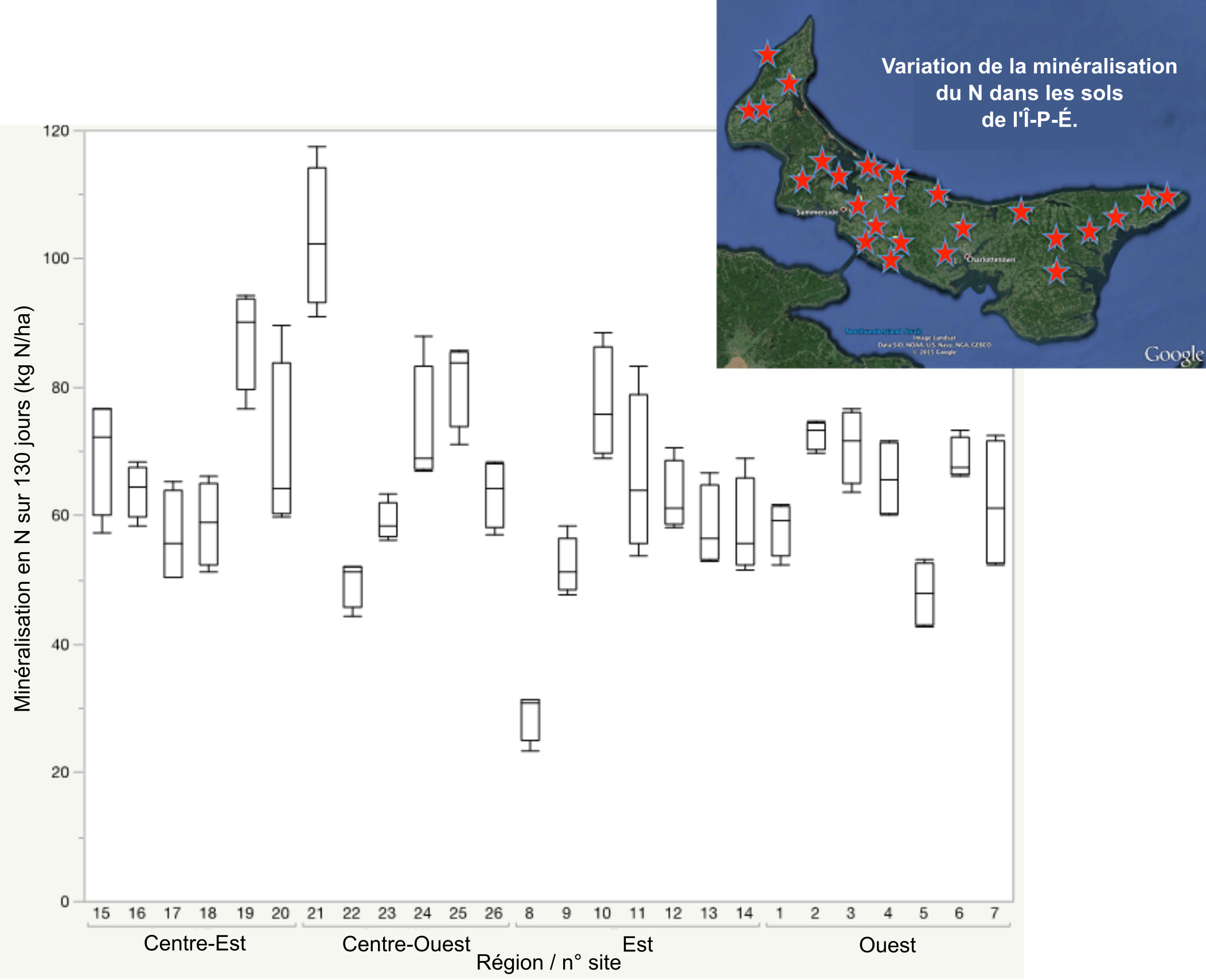
Il existe diverses approches d’estimation du potentiel de minéralisation de l’azote, approches qui vont des mesures de la qualité de la matière organique à l’activité de la communauté microbienne (Dessureault-Rompré et al. 2011). Le potentiel de minéralisation de l’azote peut varier considérablement en fonction de l’humidité du sol, de la température, du type de sol, du système de culture ou de la gestion du sol. Une étude au champ du potentiel de minéralisation de l’azote de cultures de pommes de terre en rotation triennale à l’Île-du-Prince-Édouard a montré que le potentiel de minéralisation de l’azote sur une période de croissance de 130 jours pouvait aller de 30 à 110 kg N ha-1. Alors qu’on a observé un potentiel moyen de minéralisation en N plus élevé dans les parties centrales de la province, ce sont entre les champs eux-mêmes que l’on a observé les plus grandes variations, ce qui a mis en évidence la nécessité de considérer les spécificités des sol propres à chaque site pour quantifier le potentiel de minéralisation de l’azote à partir d’analyses de sol.
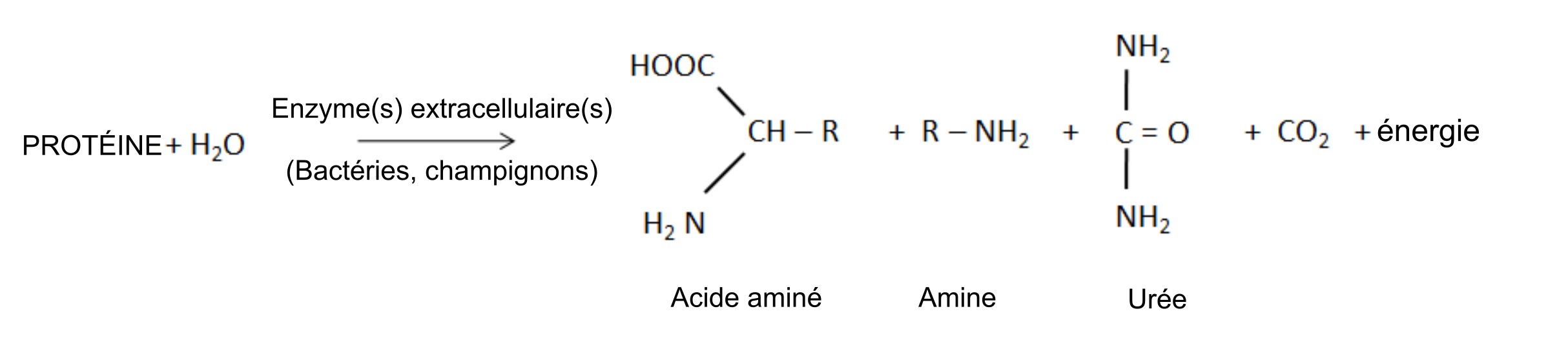
La minéralisation biologique des protéines, également appelée minéralisation azotée, est la principale source de NH4+ dans les sols non fertilisés. Ce processus naturel libère du NH4+ hydrosoluble qui provient de la décomposition des résidus végétaux, animaux et microbiens qui ont été récemment ajoutés au sol ou qui faisaient déjà partie de la matière organique du sol. Les bactéries et les champignons du sol produisent des enzymes protéases et peptidases, ainsi que des enzymes hydrolases d’acides aminés – qui défont les groupes « amine » des acides aminés – et de l’uréase – qui entraîne la dégradation la molécule d’urée. La réaction générale de minéralisation est la suivante :
 La minéralisation de l’azote se produit plus rapidement à mesure que la température du sol augmente; elle devient optimum lorsque l’humidité du sol atteint 60 %. Les conditions du sol qui favorisent l’activité bactérienne (pH de 6 à 7.5, faible salinité) stimuleront la minéralisation, car les bactéries se régénèrent plus rapidement que les champignons et ont une capacité plus élevée de production d’enzymes qui dégradent les protéines.
La minéralisation de l’azote se produit plus rapidement à mesure que la température du sol augmente; elle devient optimum lorsque l’humidité du sol atteint 60 %. Les conditions du sol qui favorisent l’activité bactérienne (pH de 6 à 7.5, faible salinité) stimuleront la minéralisation, car les bactéries se régénèrent plus rapidement que les champignons et ont une capacité plus élevée de production d’enzymes qui dégradent les protéines.
La minéralisation de l’azote dépend également du rapport de masse C:N des résidus organiques. Le rapport C:N représente la masse de carbone organique total divisée par la masse d’azote total dans une substance organique. Les résidus organiques composés d’une grande proportion de carbone organique fournissent des substrats aux microorganismes hétérotrophes qui utilisent le carbone et respirent le CO2 pour répondre aux besoins de leur métabolisme et pour produire leur biomasse. Si leur croissance se trouve limitée par un manque d’azote en provenance des résidus organiques, les microorganismes hétérotrophes immobiliseront le NH4+ et le NO3– de l’eau interstitielle du sol. Les résidus organiques avec un rapport C:N > 20 tels que les copeaux de bois, la paille et les résidus à base d’herbe ont tendance à être riches en carbone organique et relativement appauvris en azote total, ce qui provoque une immobilisation du N. Les résidus organiques présentant un rapport C:N < 20 tels que le compost d’origine alimentaire et le fumier animal décomposé sont relativement riches en azote total : ils vont donc se minéraliser et augmenter la concentration en NH4+ dans l’eau interstitielle du sol.
Plusieurs engrais fournissent du NH4+. L’engrais granulaire, tel que le sulfate d’ammonium (NH4)2SO4, est soluble dans l’eau et se dissout pour libérer le NH4+ (tableau 7.4). Les microorganismes naturellement présents dans le sol et les plantes sont dotés d’une enzyme, l’uréase, qui est capable d’hydrolyser l’engrais à base d’urée pour libérer le NH4+;
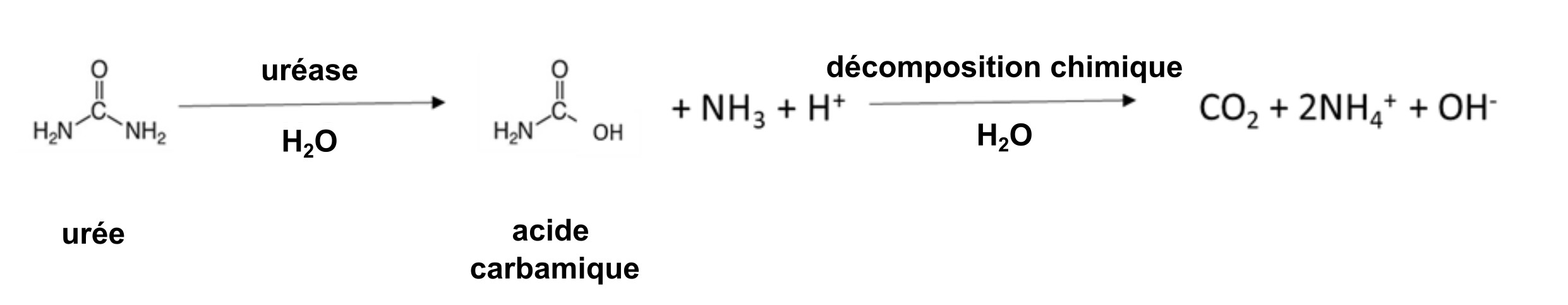 Une réaction similaire se produit dans le fumier animal, qui contient de l’urée provenant de l’urine animale. Le fumier de poule collecté dans les installations de ponte sans litière est enrichi en molécules du type urée, du fait que 80 % de l’azote excrété est sous forme d’acide urique. La transformation de l’acide urique en NH4+ peut prendre de quelques jours à une semaine dans un sol chaud et humide selon la réaction :
Une réaction similaire se produit dans le fumier animal, qui contient de l’urée provenant de l’urine animale. Le fumier de poule collecté dans les installations de ponte sans litière est enrichi en molécules du type urée, du fait que 80 % de l’azote excrété est sous forme d’acide urique. La transformation de l’acide urique en NH4+ peut prendre de quelques jours à une semaine dans un sol chaud et humide selon la réaction :
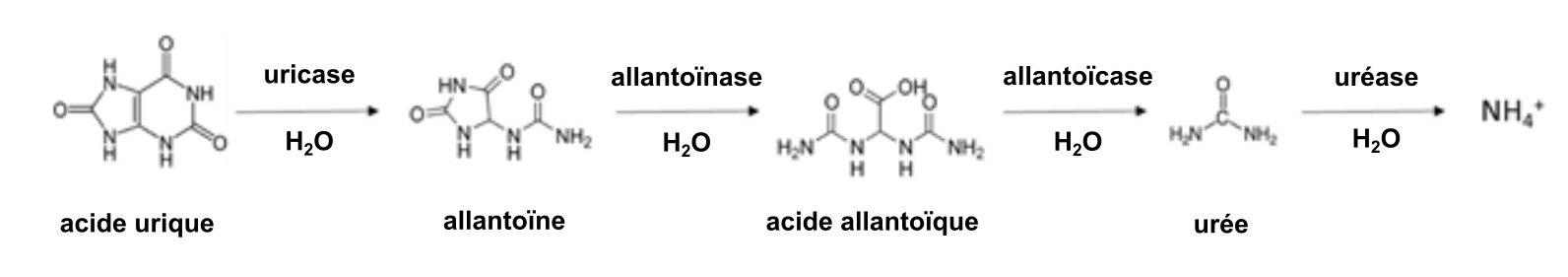 Le fumier de porc collecté lors du nettoyage des porcheries par pulvérisation et que l’on stocke sous forme liquide contient également une forte proportion de NH4+, en raison de l’hydrolyse de l’urée et de la dégradation des protéines qui se produisent au cours du stockage du fumier. Par exemple, le lisier de porc liquide contient > 90 % d’eau, a un rapport C:N de 3 et la forme NH4+ représente 75 % de sa teneur totale en N. La forte proportion d’acide urique facilement dégradable dans le fumier de poulet et la grande quantité de NH4+ soluble dans le lisier liquide de porc font de ces fumiers un engrais azoté à « libération rapide » par rapport au fumier animal mélangé à de la litière qui a un teneur en eau plus faible.
Le fumier de porc collecté lors du nettoyage des porcheries par pulvérisation et que l’on stocke sous forme liquide contient également une forte proportion de NH4+, en raison de l’hydrolyse de l’urée et de la dégradation des protéines qui se produisent au cours du stockage du fumier. Par exemple, le lisier de porc liquide contient > 90 % d’eau, a un rapport C:N de 3 et la forme NH4+ représente 75 % de sa teneur totale en N. La forte proportion d’acide urique facilement dégradable dans le fumier de poulet et la grande quantité de NH4+ soluble dans le lisier liquide de porc font de ces fumiers un engrais azoté à « libération rapide » par rapport au fumier animal mélangé à de la litière qui a un teneur en eau plus faible.
Les oxydants et nitrifiants d’ammoniac sont responsables de la transformation du NH4+ en NO3–. Les oxydants d’ammoniac appartiennent à un groupe diversifié de procaryotes, y compris les bactéries et les archées qui possèdent les gènes amo et hao, qui codent les enzymes qui catalysent la réaction en deux étapes :
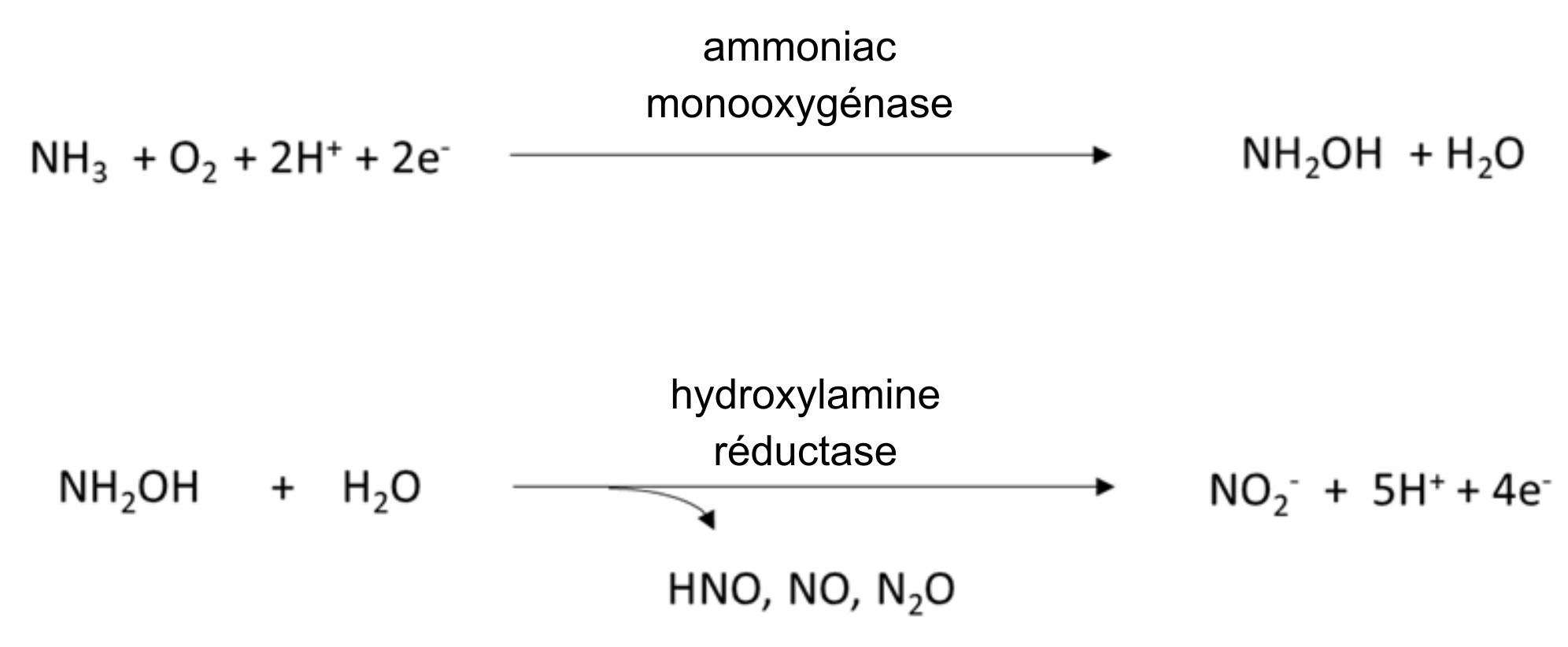 Les nitrifiants sont des procaryotes et des eucaryotes qui possèdent le gène nxr grâce auquel ils sont capables de convertir le nitrite (NO2–) en NO3– :
Les nitrifiants sont des procaryotes et des eucaryotes qui possèdent le gène nxr grâce auquel ils sont capables de convertir le nitrite (NO2–) en NO3– :
 Les réactions d’oxydation et de nitrification de l’ammoniac dans un sol se produisent rapidement au cours d’une saison de la croissance d’une culture donnée. Par conséquent, le NH4+ libéré par la minéralisation de l’azote ou ajouté par les engrais solubles ou par le fumier animal sera transformé en NO3– en quelques jours ou en quelques semaines. Cette connaissance prend toute son importance quand vient le moment de décider quand il faudrait appliquer l’engrais, car tous souhaitent que les cultures absorbent la plupart du NH4+ et du NO3– des engrais le plus rapidement possible après leur application.
Les réactions d’oxydation et de nitrification de l’ammoniac dans un sol se produisent rapidement au cours d’une saison de la croissance d’une culture donnée. Par conséquent, le NH4+ libéré par la minéralisation de l’azote ou ajouté par les engrais solubles ou par le fumier animal sera transformé en NO3– en quelques jours ou en quelques semaines. Cette connaissance prend toute son importance quand vient le moment de décider quand il faudrait appliquer l’engrais, car tous souhaitent que les cultures absorbent la plupart du NH4+ et du NO3– des engrais le plus rapidement possible après leur application.
Sinon, les réactions du cycle de l’azote élimineront ces ions nutritifs de l’eau interstitielle du sol avec pour effet de réduire la quantité d’azote disponible pour les cultures et d’augmenter le risque de pollution de l’environnement.
Matière à réflexion !
Les membranes échangeuses d’ions pour prédire l’azote minéral du sol
Les membranes échangeuses d’ions (MEI) et les simulateurs de racines des plantes ont été mis au point lors d’études agricoles et environnementales qui visaient à déterminer la disponibilité en N. En effet, les MEI contiennent sur leur surface des groupes fonctionnels chargés positivement ou négativement qui adsorbent les ions, tels que NH4+ et NO3– par attraction électrostatique. Pour maintenir l’équilibre entre la phase solide et l’eau interstitielle du sol, les MEI retirent continuellement le NH4+ et le NO3– résultant de la minéralisation du N organique ou de la désorption des surfaces organominérales.
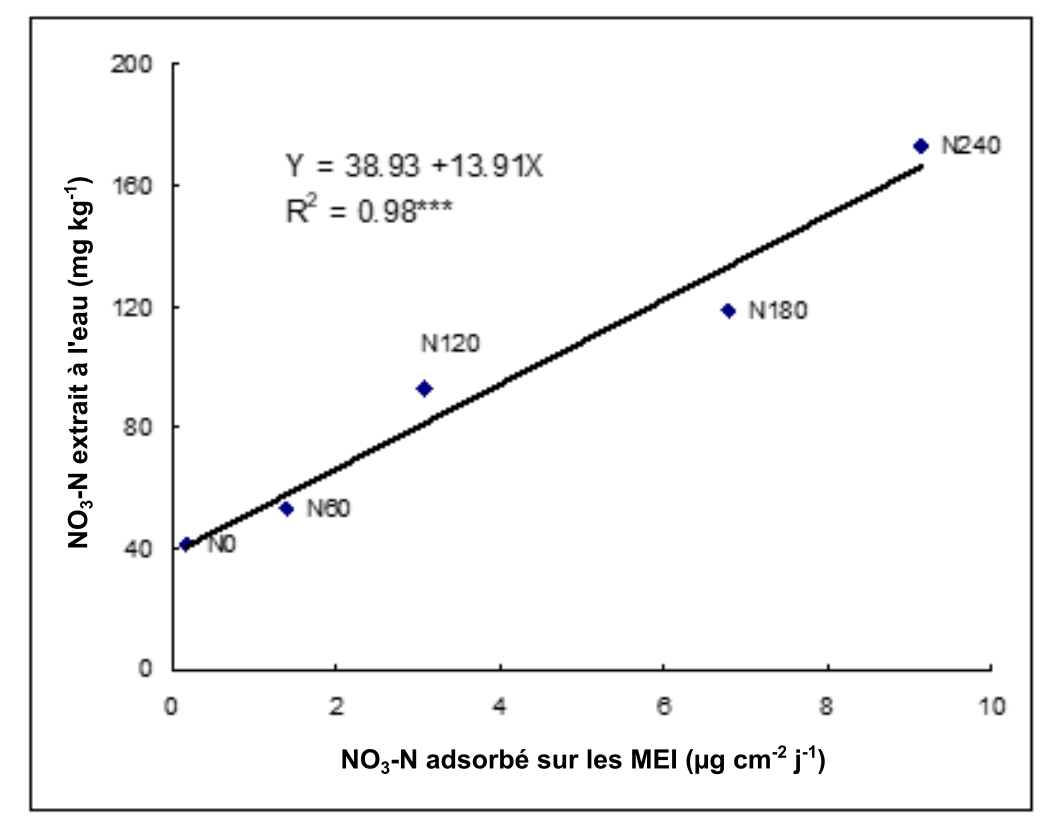
Une façon d’évaluer la concentration en NH4+ et en NO3– disponible consiste à enterrer des MEI au champ pendant une période qui dépend des objectifs de l’évaluation. On peut aussi évaluer les concentrations de NH4+ et de NO3– dans les conditions normalisées d’un laboratoire. Dans le cas de l’expérience sur le terrain, on retire du sol les MEI, on les lave à l’eau distillée sur place puis on les place dans des tubes individuels contenant soit du NaCl (membrane échangeuse d’anions) soit du HCl (membrane échangeuse de cations). Enfin, on procède aux analyses en laboratoire pour déterminer les concentrations de NO3– et de NH4+. Les MEI mesurent les flux de nitrates et d’ammonium du sol (taux d’approvisionnement) en µg cm-2 jr-1 (Ziadi et al. 1999).
En général, on observe des corrélations significatives entre les MEI et les extractions chimiques (Ziadi et al. 1999), ainsi qu’entre l’absorption d’azote par les cultures et les nitrates adsorbés sur les MEI. L’absorption d’azote par les plantes est plus étroitement liée à l’azote du sol selon l’évaluation donnée par les MEI que par l’évaluation donnée par l’extraction chimique, ce qui laisse penser que les MEI fournissent un meilleur indice de disponibilité de l’azote du sol. Dans l’ensemble des sites et des traitements appliqués (N minéral et organique), le NO3– et le NH4+ absorbés sur les membranes ont tous deux augmenté avec la dose de N appliquée. On a observé que le NO3– et le NH4+ du sol que les MEI avaient adsorbé variaient beaucoup en fonction de la saison de croissance et du stade de développement de la culture, montrant du coup la variabilité de disponibilité pour les plantes de ces formes d’azote. L’utilisation in situ de membranes échangeuses d’ions comme procédé d’analyse du sol donne une évaluation plus précise de la disponibilité de l’azote pour différentes cultures (fourrage, maïs et pomme de terre) que les méthodes standards. En raison de leur simplicité, de leur rapidité et de leur faible coût, les MEI présentent de nombreux avantages pratiques par rapport aux extractions chimiques pour l’évaluation de la disponibilité de l’azote dans le sol dans l’Est canadien.
Processus qui diminuent l’azote disponible pour les plantes
Les ions NH4+ et NO3– sont retirés de l’eau interstitielle du sol par des processus de nature biologique, chimique et physique. L’absorption de l’azote par les plantes et son immobilisation par les microorganismes découlent de leur besoin respectif en matière de synthèse des protéines et de formation de matériel génétique. Chez les plantes, l’azote est un composant majeur des protéines du cycle de Calvin (p. ex., environ de 20 à 30 % de l’azote foliaire se trouve dans l’enzyme RuBisCO (qui déclenche la production de glucides), les thylakoïdes et la molécule de chlorophylle; c’est donc un élément essentiel pour la fixation du CO2 par photosynthèse).
Les réactions biologiques du sol auxquelles participent le NO2– et le NO3– à titre d’accepteurs d’électrons sont courantes. Ces réactions permettent aux bactéries et aux champignons d’acquérir de l’oxygène lorsque l’environnement du sol présente des conditions anoxiques. La teneur élevée en humidité du sol peut créer des conditions anoxiques, tout comme l’activité biologique intense qui consomme de l’oxygène et produit du dioxyde de carbone, comme dans la rhizosphère ou dans la détritusphère (c.-à-d. autour de la matière organique en décomposition). La nitrification-dénitrification est l’une de ces réactions et elle se produit lorsque la teneur en eau du sol est comprise entre 50 et 80 %.
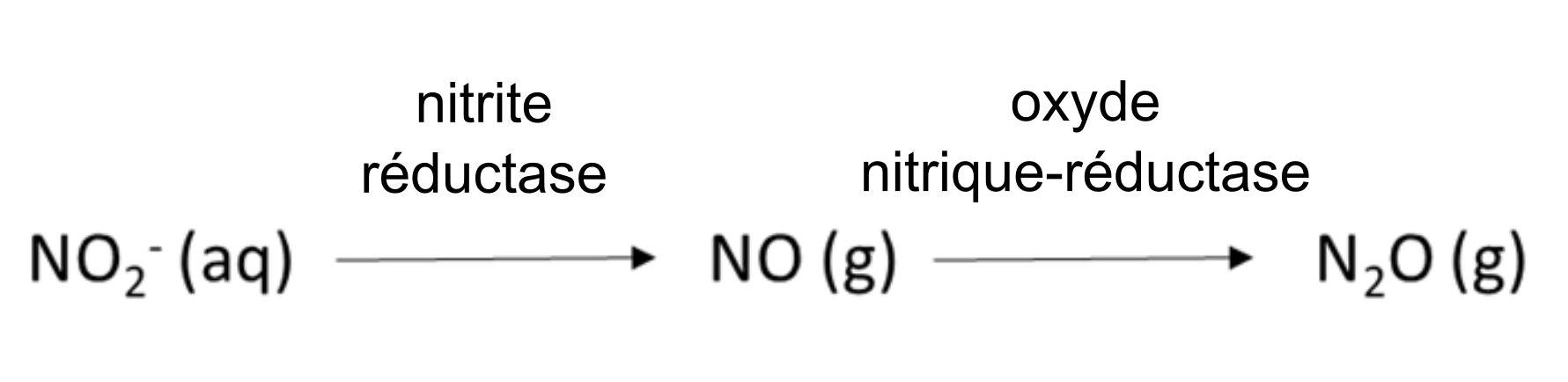 La dénitrification est une autre réaction de réduction biologique qui consomme du NO3–; elle se produit lorsque la teneur en eau du sol dépasse 80 %.
La dénitrification est une autre réaction de réduction biologique qui consomme du NO3–; elle se produit lorsque la teneur en eau du sol dépasse 80 %.
 Par ailleurs, une réaction chimique qui fait diminuer la concentration de NH4+ est la volatilisation de NH3, qui se produit lorsque le NH4+ est déprotoné. Lors de l’hydrolyse de l’urée, de l’acide carbonique peut se former :
Par ailleurs, une réaction chimique qui fait diminuer la concentration de NH4+ est la volatilisation de NH3, qui se produit lorsque le NH4+ est déprotoné. Lors de l’hydrolyse de l’urée, de l’acide carbonique peut se former :
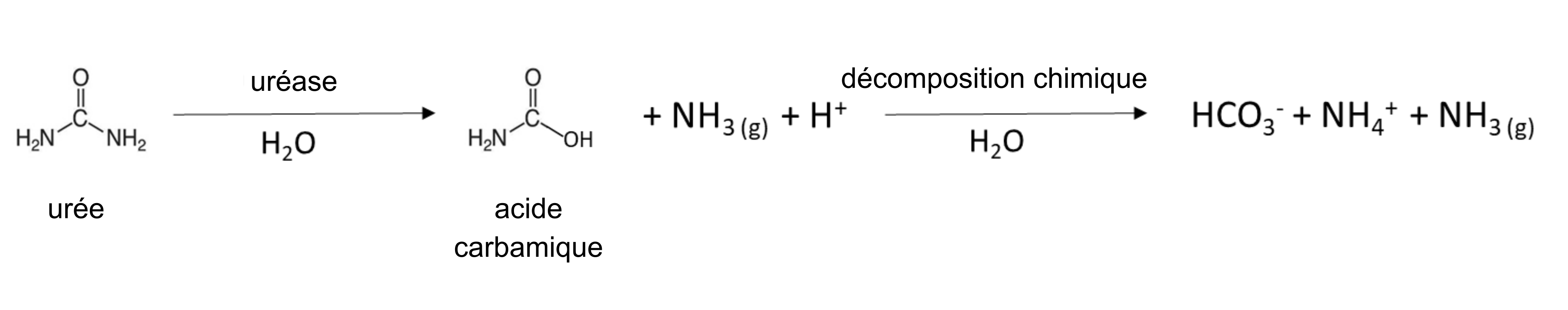
Le fumier animal peut perdre jusqu’à 50 % de l’azote total excrété par les animaux sous forme de NH3 (g) pendant son stockage et son épandage. L’engrais à base d’urée est également sensible à la perte de NH3 (g), en particulier dans les sols alcalins qui ont un excès d’OH– et de HCO3– dans l’eau interstitielle du sol, car le H+ s’associe à ces contre-anions plutôt qu’à NH3. La volatilisation du NH3 (g) n’est pas souhaitable, car le transfert d’azote gazeux des champs agricoles vers l’atmosphère réduit l’azote disponible pour les cultures. Le NH3 (g) retournera éventuellement au sol sous forme de dépôts humides et secs, ce qui entraînera l’enrichissement involontaire des terres non agricoles et des systèmes aquatiques.
La fixation d’ammonium définit la réaction qui retire du NH4+ des pores du sol remplis d’eau (l’eau interstitielle). La réaction se produit lorsque le NH4+ se trouve absorbé sur les sites d’échange des surfaces organominérales. La fixation de l’ammonium est plus importante dans les sols argileux parce qu’ils ont une plus grande surface réactive et plus de sites d’adsorption dans leurs inter-feuillets (argiles 2:1 seulement) que les sols sableux. En raison de sa charge 1+ et de son faible rayon ionique, NH4+ est susceptible de se lier à l’inter-feuillet, ce qui réduit la quantité de NH4+ dans l’eau interstitielle du sol. Cela pourrait représenter une réserve de 90 à 460 mg de NH4+ kg-1 dans les argiles à texture fine. En revanche, la molécule NO3– est faiblement retenue dans la matrice du sol, en raison de sa taille et de sa charge négative; elle est ainsi plus susceptible de passer à travers le profil du sol, autrement dit de s’éloigner de la zone racinaire de la culture. Le lessivage des nitrates est influencé par la porosité du sol et le taux d’infiltration dans le sol de l’eau après la fonte des neiges, les précipitations et les événements d’irrigation. Enfin, le NH4+ et le NO3– sont tous deux susceptibles d’être perdus dans le sol par les processus d’érosion et de ruissellement de surface. Le vent et l’eau érodent les particules de sol qui contiennent du NH4+ adsorbé, tandis que les eaux de ruissellement transportent le NO3– des sols saturés par écoulement de surface.
Matière à réflexion !
Optimiser le taux d’apport d’azote du fumier animal

Équilibrer le taux d’application d’azote avec celui prélevé par la culture récoltée au fil du temps empêche l’accumulation excessive de nitrate dans le sol. Le nitrate inutilisé peut migrer lentement en profondeur sous la zone d’enracinement au fil du temps avec l’eau de percolation. Dans le cadre d’un essai réalisé dans le Centre-Est de la Saskatchewan, on a appliqué chaque année pendant huit ans du lisier de porc à un taux agronomique recommandé de 37 000 L ha-1 an-1 – un ajout d’environ 80 kg N ha-1 an-1 – ce qui équivalait à peu près à la quantité d’azote exportée lors de la récolte annuelle des céréales. Ce taux d’application a entraîné peu ou pas d’accumulation de nitrate dans le profil du sol et il n’y a eu aucune preuve de lessivage en profondeur par rapport à un témoin non fertilisé (en bas à droite).
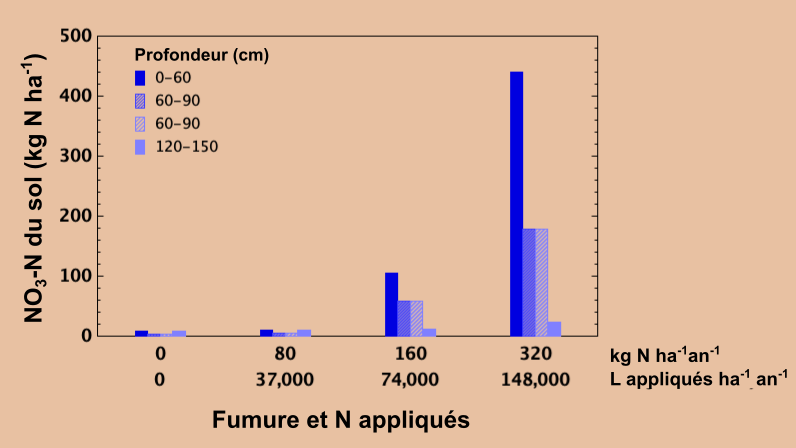
Dans le témoin non fertilisé, la production végétale a beaucoup baissé avec les années en raison du manque d’azote disponible, alors que le rendement de la production végétale s’est révélé bon avec l’application de lisier au cours de ces années. À des taux d’application annuels doublés (74 000 L ha-1 an-1) et quadruplés 148 000 L ha-1 an-1) par rapport au taux agronomique recommandé, les teneurs en nitrate du sol dans les 60 cm supérieurs ainsi que dans le profil sous-jacent se sont révélées élevées par rapport au taux agronomique et au témoin non fertilisé. De grandes quantités de nitrate inutilisé qui s’accumulent dans le profil du sol au fil du temps peuvent migrer lentement plus en profondeur. S’il est lessivé suffisamment profondément, il peut devenir inaccessible aux racines des plantes et constituer une source potentielle de contamination des eaux souterraines. Avec un taux d’application approprié qui correspond aux besoins de la culture, ces pertes peuvent être évitées.
Cycle du phosphore
Réactions qui contribuent au phosphore disponible pour les plantes
Le phosphore disponible pour les plantes découle de processus de nature biologique et géochimique (figure 7.9). La source biologique du phosphore disponible est le phosphore organique qui se fait hydrolyser par les enzymes phosphatases des racines des plantes et des microorganismes du sol. Les composés organiques du phosphore sont abondants dans les résidus végétaux et dans la matière végétale non digérée. Les inositols sont des composés de stockage majeurs de phosphate qui contribuent à la biosynthèse des parois cellulaires, à la communication entre cellules, au stockage et au transport des hormones végétales et d’autres molécules liées au stress et à l’osmorégulation. La dégradation du myo-inositol libère du H2PO4– soluble dans l’eau, comme suit :
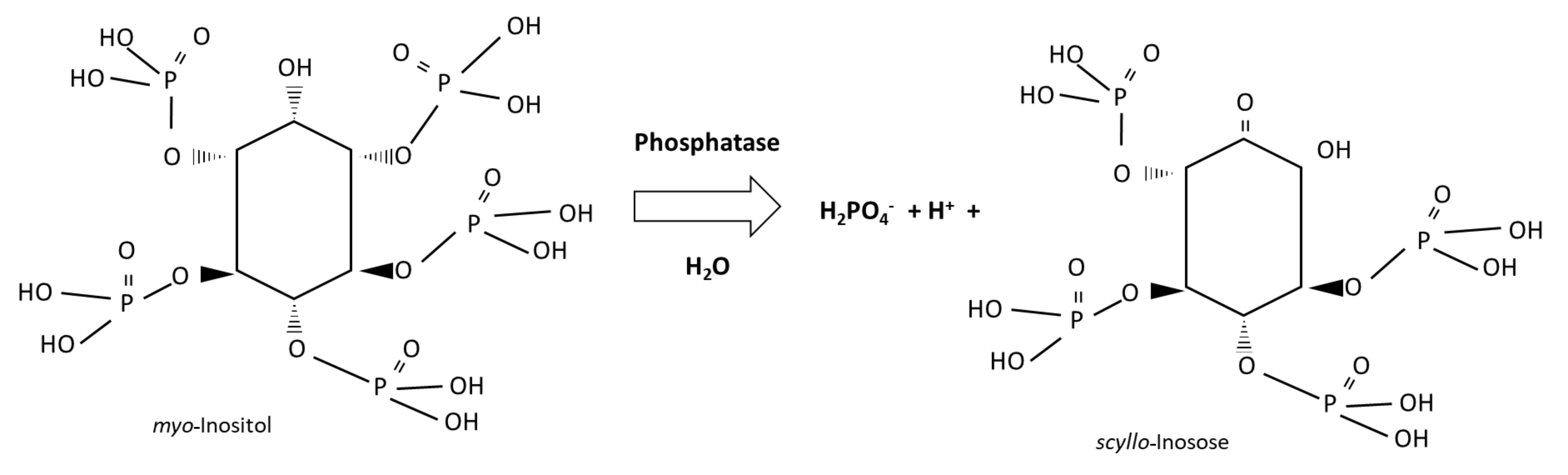
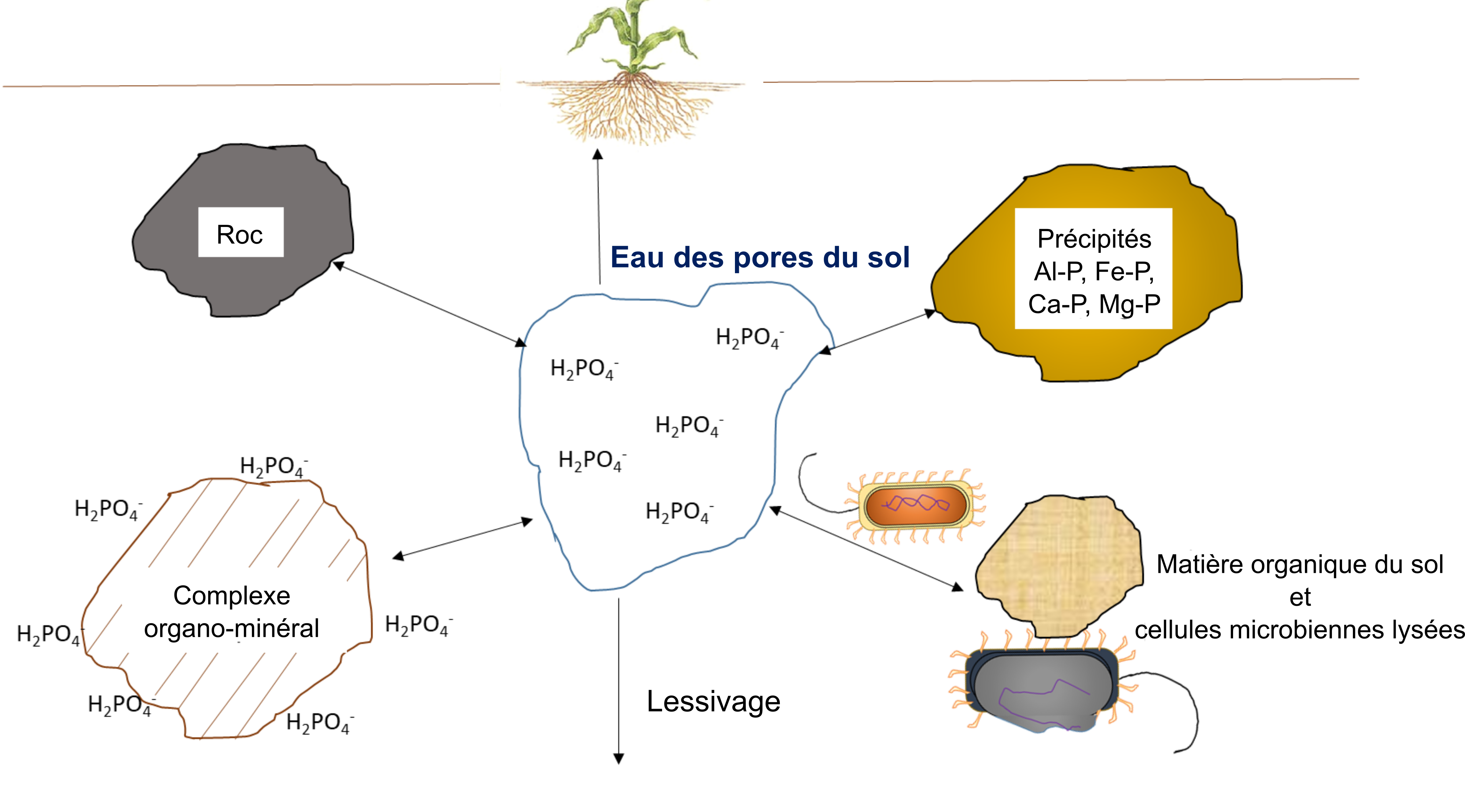
Figure 7.9. Version simplifiée du cycle du phosphore du sol. © Joann Whalen, sous licence CC BY (Attribution).L’altération des minéraux primaires, tels que l’apatite, a pour effet de libérer du H2PO4– dans l’eau interstitielle du sol. D’autres sources géochimiques comprennent du H2PO4– résultant de la désorption des argiles ou de la dissolution de minéraux secondaires, par exemple, les phosphates de fer, d’aluminium, de calcium et de magnésium. Les processus d’altération et de dissolution nécessitent de l’eau. La dissolution des phosphates de calcium et des phosphates de magnésium est accélérée par la présence d’acide carbonique (H2CO3 ↔ HCO3– + H+) et d’autres substances acides. Cependant, les phosphates de fer et les phosphates d’aluminium deviennent moins solubles dans les sols acides. Les acides inorganiques qui contribuent à la solubilisation de H2PO4– des phosphates de calcium et ceux de magnésium sont le H2SO4 et le HCl.
Les acides organiques produits par les racines des plantes et les microorganismes du sol abaissent le pH dans leur environnement, ce qui entraîne une solubilisation localisée de H2PO4–; de plus, les acides organiques peuvent déplacer le H2PO4– qui est adsorbé sur l’argile et les surfaces organominérales.
Les acides organiques qui sont efficaces à cet égard comprennent les acides acétique, lactique, malonique, malique, tartrique, oxalique, citrique, ρ-hydrobenzoïque et salicylique. On peut isoler les bactéries du sol qui produisent des acides organiques, tels que celles des genres Pseudomonas, Bacillus, Rhizobium et Burkholderia, les cultiver puis les réintroduire dans le sol afin d’augmenter le H2PO4– libéré par dissolution, mais leur fiabilité à la solubilisation du H2PO4– dans les conditions au champ reste encore à prouver. Les champignons mycorhiziens arbusculaires produisent également des acides organiques qui augmentent le H2PO4– soluble dans l’eau, qu’ils absorbent ensuite grâce à leurs hyphes extraradiaux. Étant donné que les champignons mycorhiziens arbusculaires sont des symbiotes végétaux, ils peuvent transférer à leur plante hôte une partie du H2PO4– qu’ils ont absorbé au moyen de transporteurs de phosphore à faible et haute affinité.
Impact à long terme des pratiques de travail du sol et de la fumure phosphatée sur les formes de phosphore du sol, tel qu’il a été déterminé par spectroscopie par résonance magnétique nucléaire du 31P
Les pratiques de conservation du sol (système de culture sans travail du sol aussi appelé labour minimum ou semi-direct [SD]) visent le moins possible à perturber le sol et à le mélanger. De telles pratiques ont gagné en essor ces dernières années à dessein de réduire les pertes hors site d’éléments nutritifs associés aux particules érodées, dont le phosphore (P). Cependant, la mise en œuvre de telles pratiques a pour effet de maintenir les résidus de culture et les engrais à la surface du sol; les éléments nutritifs relativement immobiles, soit ceux qui ne se déplacent pas facilement le long du profil de sol, tendent à rester à sa surface ou près de celle-ci. Par conséquent, le système de culture sans travail du sol a pour effet de maintenir des concentrations élevées d’éléments nutritifs à la surface du sol (0 à 5 cm) et des concentrations faibles en dessous. On a étudié l’impact des pratiques de travail du sol et de la fertilisation en P sur les formes de P du sol dans le cadre d’une expérience de rotation à long terme maïs-soja établie en 1992 au Québec qui visait à comparer le SD au labour à la charrue conventionnelle. Les résultats, déterminés à l’aide de la spectroscopie par résonance magnétique nucléaire (RMN) du 31P, ont montré :
- qu’il y avait eu beaucoup de variations dans le phosphore total en fonction de la profondeur du sol avec le traitement de SD, celui-ci s’accumulant dans la couche supérieure du sol non fertilisé (0–5 cm) et dans la couche de 0–10 cm du sol où l’on avait appliqué l’engrais contenant du P;
- que le pH, le P disponible et le carbone total avaient des valeurs significativement plus élevées dans la couche arable (0 à 5 cm) que dans les couches du dessous (de 5 à 20 cm) avec le traitement de SD; que le N total s’était également accumulé dans les 10 premiers cm du sol;
- qu’à l’inverse, la distribution des éléments nutritifs s’était révélée homogène dans l’ensemble du profil du sol dans le cas du traitement de pratique conventionnelle, ce qui laisse penser que la stratification observée dans le traitement de SD résulte de la rétention des résidus de culture à la surface du sol;
- que les spectres RMN du 31P ont montré une stratification concomitante de l’orthophosphate dans les parcelles de traitement de SD qui avaient reçu 35 kg de P ha-1;
- que l’accumulation de scyllo-IP6 et de nucléotides dans les couches plus profondes était peut-être due à leur mouvement préférentiel à travers la colonne de sol, tandis que les concentrations de pyrophosphate et d’ADN étaient plus élevées à la surface (0–5 cm) que dans les couches profondes;
- le C et le N total avaient été affectés de la même manière, ce qui laisse penser que l’ADN aurait été synthétisé en plus grande quantité dans les parcelles de traitement de SD que dans celles au traitement de pratique conventionnelle, en raison du taux supérieur d’accumulation de matière organique dans les premières.
Dans l’ensemble, il semble que l’accumulation de P inorganique labile à la surface du sol avec le traitement SD puisse augmenter le risque de perte de P inorganique soluble dans le ruissellement de surface et entraîner la perte de mono-esters organiques par drainage suivant différentes voies hydrologiques. Plus d’information à lire dans Abdi et coll. (2014).
Réactions qui diminuent le phosphore disponible pour les plantes
Les ions H2PO4– sont retirés de l’eau interstitielle du sol par des processus de nature biologique, chimique et physique. L’absorption du P par les plantes et l’immobilisation dans la biomasse microbienne leur servent principalement au stockage de l’énergie, aux réactions de transfert, dans la formation d’acides nucléiques et de phospholipides.
Les réactions de rétention du P réduisent la concentration de H2PO4– dans l’eau interstitielle du sol, car celui-ci s’adsorbe sur les surfaces organominérales et à la surface des sesquioxydes de fer et d’aluminium, à savoir l’oxyde de fer (Fe2O3), l’hydroxyde de fer (Fe(OH)3) et l’hydroxyde d’aluminium (Al(OH)3). Ces réactions sont courantes dans les sols acides, mais se produisent aussi dans tous les sols dans une certaine mesure. En général, les sols avec une teneur en argile élevée adsorbent beaucoup de H2PO4–, en particulier lorsqu’ils contiennent des argiles gonflantes du type 2:1 telles que la smectite. Les sesquioxydes hydratés de fer et d’aluminium se lient étroitement au H2PO4– rendant son absorption impossible pour les plantes. De plus, H2PO4– précipite avec le Fe, l’Al et le Ca présents dans l’eau interstitielle du sol. Cela produit des précipités tels que Fe(OH)2·H2PO4 et, dans les sols acides, le composé de type variscite, Al(OH)2·H2PO4. Dans les sols neutres à alcalins, le H2PO4– précipite avec le Ca pour former du phosphate dicalcique dihydraté légèrement soluble, le CaHPO4. Il y réaction ultérieure avec le Ca(OH)2 et le CaCO3 dans les sols alcalins, qui conduit à la formation d’hydroxyapatite insoluble (p. ex. [Ca3(PO4)2]3·CaOH2) ou d’apatitie carbonatée insoluble (p. ex., carbonato-apatite : [Ca3(PO4)2]3·CaCO3).
Le recours au concept de saturation en phosphore est une autre façon de décrire la capacité du sol à retenir le H2PO4– lié chimiquement. Le sol est brassé avec une solution extractive telle que la solution de Mehlich 3, la quantité de P et d’Al extractibles est mesurée et le rapport est calculé comme suit :
(1)
Un sol caractérisé par un degré élevé de saturation en phosphore a une quantité élevée de H2PO4– par rapport à la quantité d’Al extractible qui pourrait se lier avec H2PO4–. Par conséquent, plus de H2PO4– soluble dans l’eau reste dans l’eau interstitielle du sol menant à davantage de lixiviation après la fonte des neiges, les précipitations et les épisodes d’irrigation. De plus, l’érosion des particules de sol qui contiennent du H2PO4– adsorbé transportera le P particulaire, tandis que le ruissellement de surface transportera les composés du phosphore dissous à la surface du sol. L’ampleur de la perte de phosphore par ces voies dépend de la concentration de P soluble dans l’eau et de P particulaire dans le sol en surface, ainsi que de la quantité de lixiviation et de la gravité des processus d’érosion de surface.
Cycle du soufre
Réactions qui contribuent au soufre disponible pour les plantes
Le soufre disponible pour les plantes peut provenir de l’altération du matériau d’origine, des dépôts atmosphériques, de la dissolution du gypse (CaSO4) et de la minéralisation de la matière organique (figure 7.10). Les roches plutoniques telles que la pyrite contiennent du soufre élémentaire (So) qui est oxydé en SO42- au cours du processus d’altération. La plupart des réactions d’oxydation sont produites par des champignons et des bactéries autotrophes, tels que Thiobacillus, qui est abondant dans la rhizosphère.
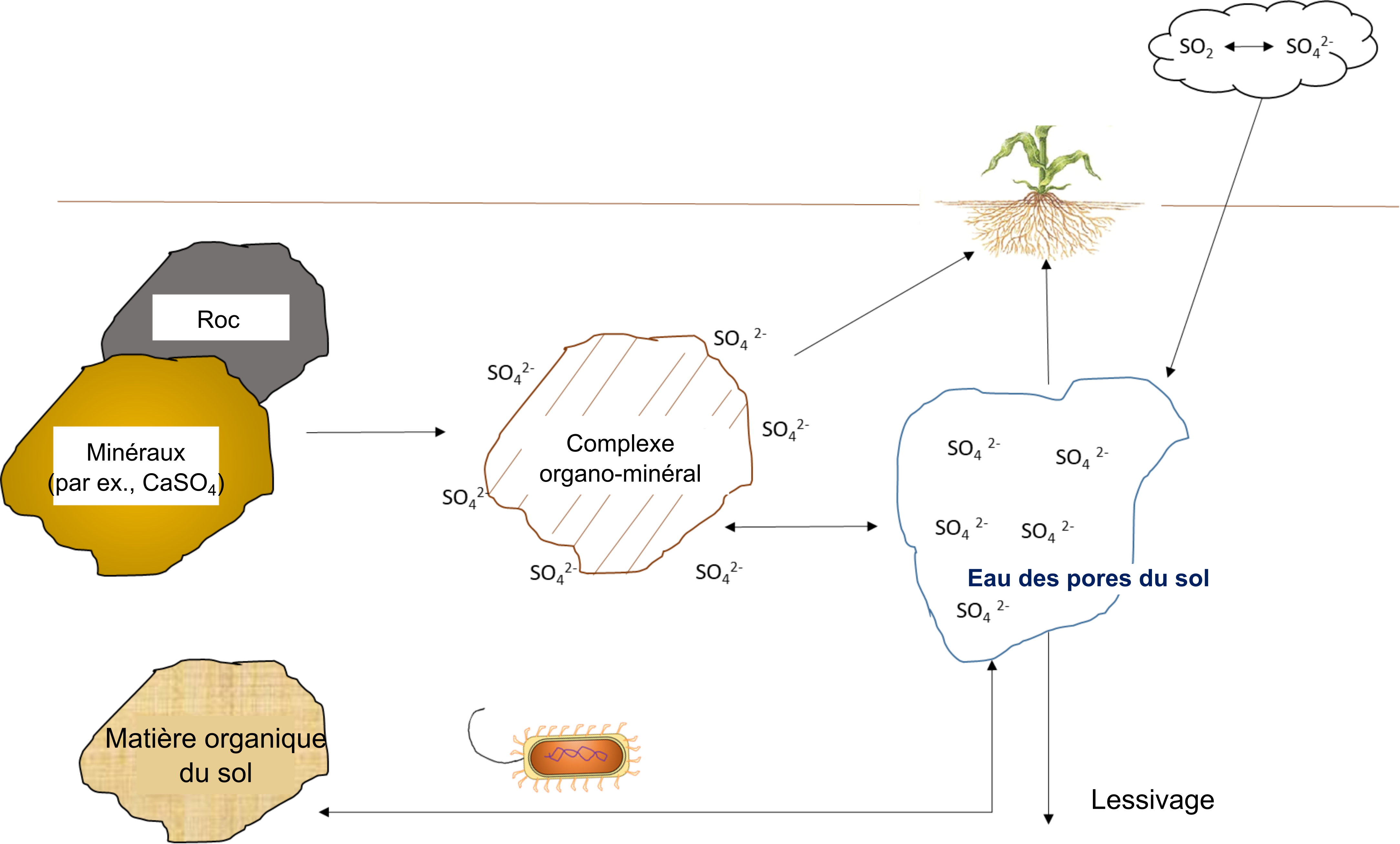
La conversion du SO42- est extrêmement variable dans les sols, du fait de la variation naturelle de la répartition des microorganismes qui oxydent le soufre. En général, les réactions d’oxydation du soufre se produisent rapidement dans les sols plus chauds ayant une teneur en eau d’environ 60 % et un pH de 6 à 7,5. De plus, du SO42- est libéré par la dissolution de sels hydratés dans le sol, tels que CaSO4·2H2O et MgSO4·7H2O.
Il y a aussi du soufre de source atmosphérique qui se dépose sur la surface du sol sous forme de dépôts secs ou humides et qu’il finit par y pénétrer. Plusieurs phénomènes naturels émettent du soufre dans l’atmosphère, notamment des composés soufrés particulaires qui proviennent de l’altération des croûtes continentales (poussières) et des embruns marins. De petites particules de soufre sont transportées par le vent et déposées à la surface du sol ou sur la végétation. D’autres sources naturelles comprennent les émissions gazeuses de dioxyde de soufre, de sulfure d’hydrogène, de sulfure de diméthyle et d’autres gaz provenant des éruptions volcaniques, des marécages et des zones humides côtières. Dans l’atmosphère, ces gaz ont tendance à s’oxyder en acide sulfurique et en sulfate d’aérosol avant de retomber au sol avec la pluie et la neige. Ces sources biogéniques de soufre représentent moins de 10 kg S ha-1 an-1 dans les écosystèmes terrestres. Depuis la révolution industrielle, les sources anthropiques de soufre ont contribué de manière significative au cycle du soufre dans les sols, contribution qui pourrait dépasser >50 kg S ha-1 an-1 dans les terres agricoles et forestières situées à proximité des industries. La combustion des combustibles fossiles, la combustion de biomasse, l’incinération des déchets et l’utilisation d’explosifs émettent toutes du dioxyde de soufre et contribuent donc par l’intermédiaire des dépôts atmosphériques humides à faire augmenter la quantité de soufre dans le sol. Cependant, l’application de mesures de réduction de la pollution de l’air a eu pour effet de réduire la quantité de soufre apportée par ces sources.
Les enzymes du sol – les sulfatases – d’origine végétale et microbienne minéralisent le soufre organique, ce qui libère du SO42-, comme il est illustré ci-dessous :
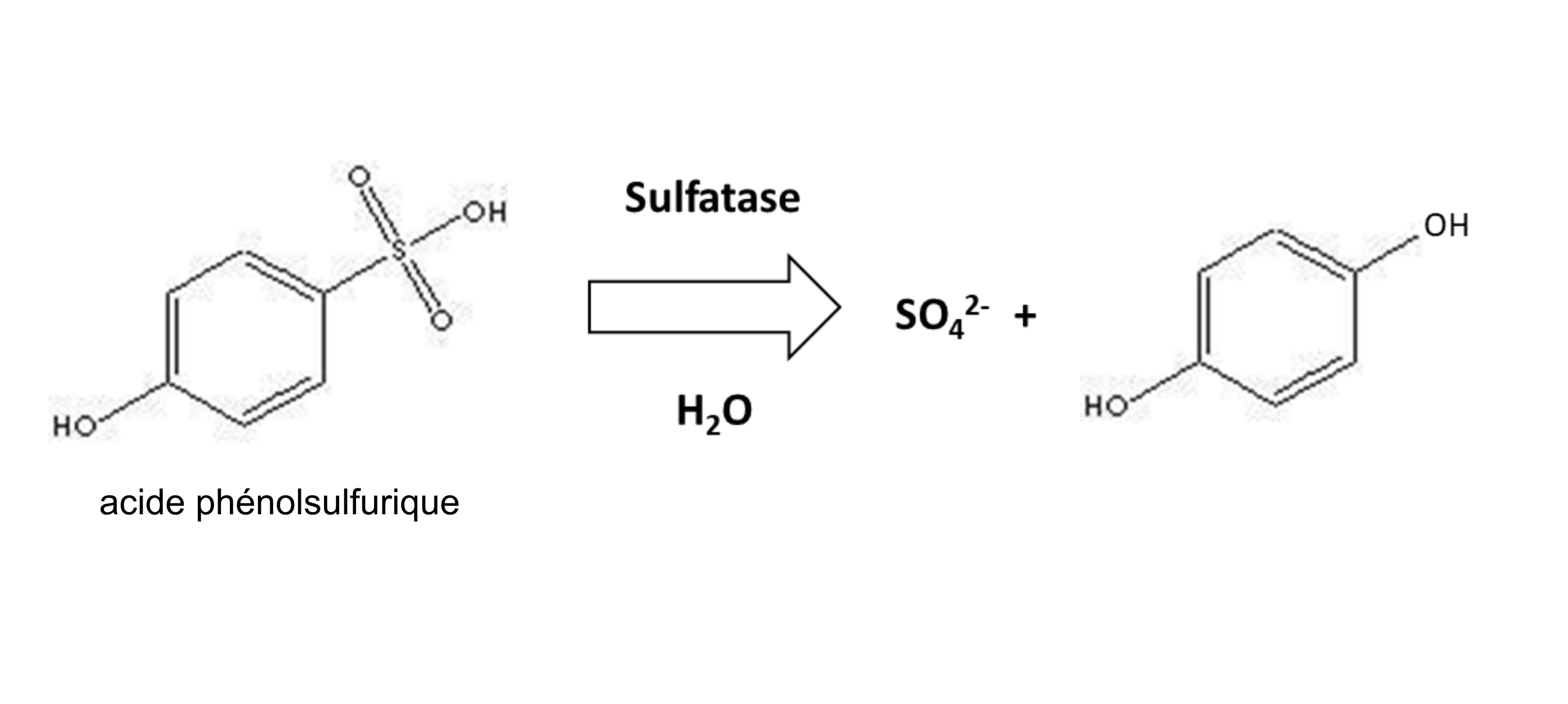 Comme d’autres réactions de minéralisation, la minéralisation du soufre augmente avec la température du sol pour atteindre un optimum lorsque la teneur en eau du sol est d’environ 60 % et que le pH est presque neutre. La minéralisation du soufre est plus active autour des racines des plantes qu’ailleurs dans le sol, car elles peuvent produire de la sulfatase. Les plantes absorbent aussi une partie du SO42- de la solution du sol, ce qui pourrait limiter la quantité de SO42- disponible pour les microorganismes et donc inciter ces derniers à synthétiser de la sulfatase. Lorsque des résidus végétaux ou animaux frais sont ajoutés au sol, le rapport carbone organique/soufre organique (C:S) du matériau déterminera sa susceptibilité à la minéralisation. Les résidus organiques qui présentent un rapport C:S <200 sont facilement minéralisés, ce qui libère du SO42- dans la solution du sol. Cependant, les microorganismes immobiliseront pour leur propre besoin métabolique du SO42- des résidus organiques qui présentent un rapport C:S >400 et qui ont une faible teneur en soufre.
Comme d’autres réactions de minéralisation, la minéralisation du soufre augmente avec la température du sol pour atteindre un optimum lorsque la teneur en eau du sol est d’environ 60 % et que le pH est presque neutre. La minéralisation du soufre est plus active autour des racines des plantes qu’ailleurs dans le sol, car elles peuvent produire de la sulfatase. Les plantes absorbent aussi une partie du SO42- de la solution du sol, ce qui pourrait limiter la quantité de SO42- disponible pour les microorganismes et donc inciter ces derniers à synthétiser de la sulfatase. Lorsque des résidus végétaux ou animaux frais sont ajoutés au sol, le rapport carbone organique/soufre organique (C:S) du matériau déterminera sa susceptibilité à la minéralisation. Les résidus organiques qui présentent un rapport C:S <200 sont facilement minéralisés, ce qui libère du SO42- dans la solution du sol. Cependant, les microorganismes immobiliseront pour leur propre besoin métabolique du SO42- des résidus organiques qui présentent un rapport C:S >400 et qui ont une faible teneur en soufre.
Les réactions qui diminuent le soufre disponible pour les plantes
Les ions SO42- dans l’eau interstitielle du sol sont extraits par des processus de nature biologique, chimique et physique. L’absorption biologique du SO42- par les plantes et les microorganismes est nécessaire à la synthèse des acides aminés essentiels (méthionine, cystéine, homocystéine et taurine), à la production de glucosinolates, de vitamines, en tant que cofacteur enzymatique et à la production de chlorophylle. Dans les sols anoxiques, les accepteurs d’électrons de soufre gagnent des électrons et diminuent leur état d’oxydation, de sorte que le SO42- devient réduit en soufre élémentaire So puis en S2- par des bactéries réductrices de soufre dans le phylum des Firmicutes, qui comprend les genres Desulfotomaculum, Desulfosporomusa et Desulfosporosinus.
De nombreuses réactions chimiques réduisent la concentration de SO42- dans l’eau interstitielle du sol. Dans les sols calcaires, le SO42- peut coprécipiter en présence de CaCO3 pour former du CaCO3·CaSO4. Ce phénomène représente environ 10 % du soufre total dans les sols calcaires. Un second phénomène se produit sur les surfaces organominérales : le SO42- se lie aux sites d’échange d’anions qui s’y trouvent. Cependant, le SO42- n’est pas aussi étroitement lié aux sites d’échange d’anions que le sont le HPO42- et le H2PO4–.
Par conséquent, en étant sensible au lessivage, le SO42- risque d’être facilement emporté sous l’effet de l’érosion et du ruissellement.
Potassium, Calcium et Magnésium
Le cycle des éléments minéraux – potassium, calcium et magnésium – est régi par des processus géochimiques (figure 7.11). Bien que les plantes et autres organismes nécessitent des quantités substantielles de potassium, de calcium et de magnésium, ce n’est que sous leur forme ionique qu’ils servent dans les tissus biologiques. Par exemple, le potassium existe principalement sous forme de K+ dans la solution vasculaire des tissus végétaux et dans le cytoplasme des cellules végétales. Il est transporté avec l’eau dans les plantes. Il peut se trouver entre des couches de composés organiques tels que des polysaccharides, des protéines et des lipides, mais il ne se lie pas de manière covalente à ces substances. Le lessivage du K+ et d’autres éléments minéraux tels que le Ca2+ et le Mg2+ des plantes se produit lorsque les précipitations entrent en contact avec des résidus végétaux et animaux avant même que la décomposition biologique ne commence.
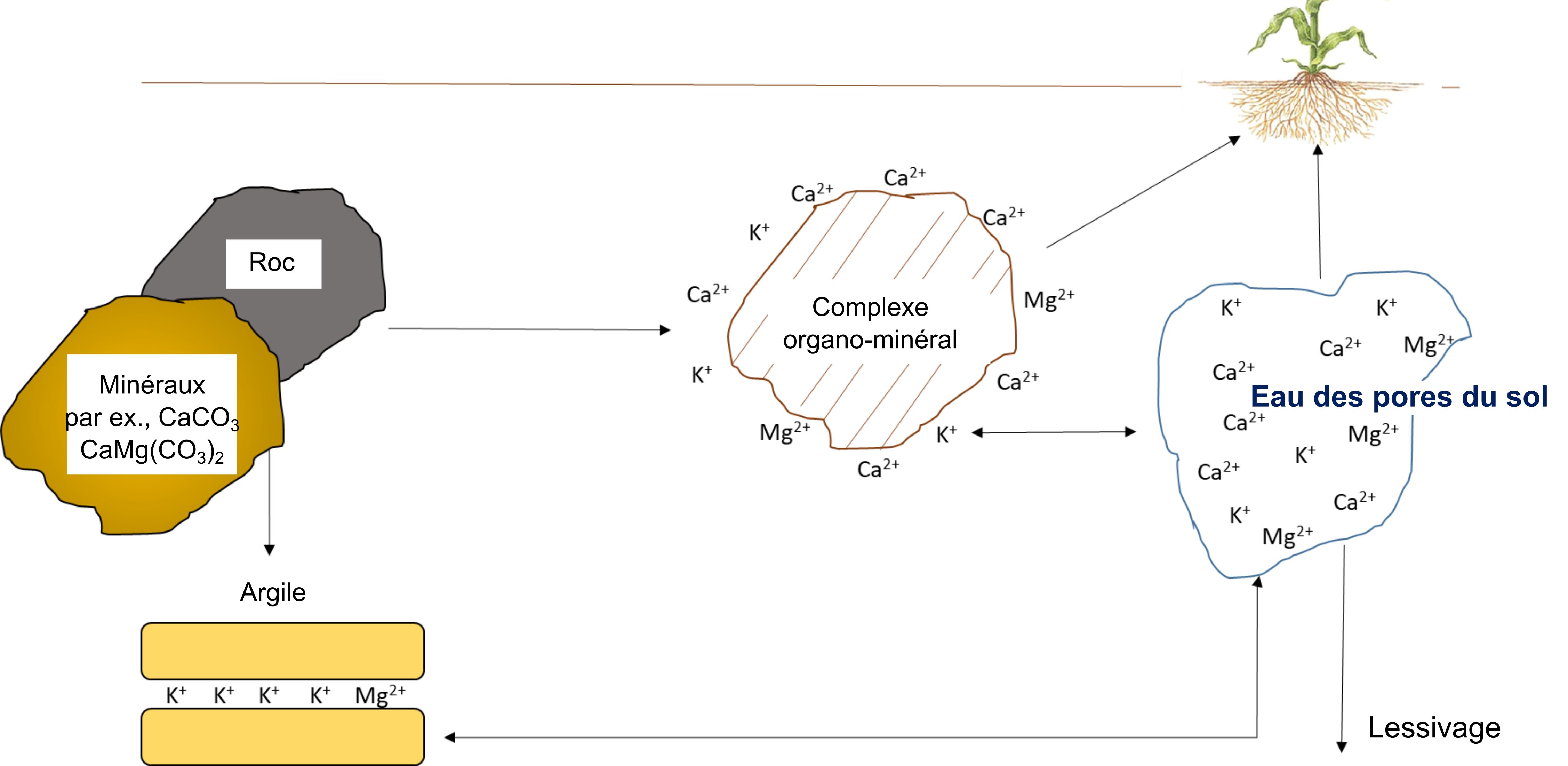
Reactions that contribute plant-available potassium, calcium and magnesium
La quantité de K+, de Ca2+ et de Mg2+ dans l’eau interstitielle du sol et sur les sites d’échange cationique dépend de la nature et du degré d’altération du matériau d’origine. Les résidus organiques sont des contributeurs mineurs de K+, de Ca2+ et de Mg2+ solubles dans l’eau par rapport à la contribution apportée par le matériau d’origine. Le potassium provient de minéraux primaires, tels que le feldspath, le microcline, le mica et la biotite, de même qu’il peut provenir d’engrais.
Réaction de la fertilité du sol à la nutrition des cultures intensives

De 2002 à 2006, une culture en rotation maïs-soja dans le champ d’un producteur du Centre-Sud de l’Ontario a été suivie à des fins d’évaluation des changements découlant de ce mode de gestion intense. L’essai a consisté à la mise en place de sept combinaisons de traitements : trois taux différents de K des intrants suggérés par le producteur et quatre taux d’intrants d’intensité supérieure, où l’on a fait varier à la fois le taux de K et le mode de placement de l’engrais.
Le sol était un loam London bien drainé. L’évaluation de la fertilité initiale du sol a révélé la présence de 8 ppm P de Olsen (faible) et de 107 ppm de K extractible à l’acétate d’ammonium (moyen). Dans le cas de cinq traitements, on a utilisé la pratique du travail de conservation du sol du producteur : charrue à chisel à l’automne avec travail secondaire du sol au printemps. Dans le cas des deux autres traitements, on a procédé à du travail partiel du sol à l’automne, suivi d’un travail partiel du sol au printemps. Chaque parcelle de traitement couvrait une bande de huit rangées de large qui s’étendait sur toute la longueur (300 à 450 m) du champ (voir la photo à droite).
Il n’y a eu qu’une légère augmentation des rendements moyens sur cinq ans résultant de l’augmentation des taux de K et de l’intensification de la rotation. Aucune combinaison d’intensité d’intrants et de taux de K ne s’est montrée plus rentable que l’intensité de rotation actuelle du producteur. Aucun besoin supplémentaire de K de la part d’une culture avec l’augmentation d’intrants n’a été démontré.
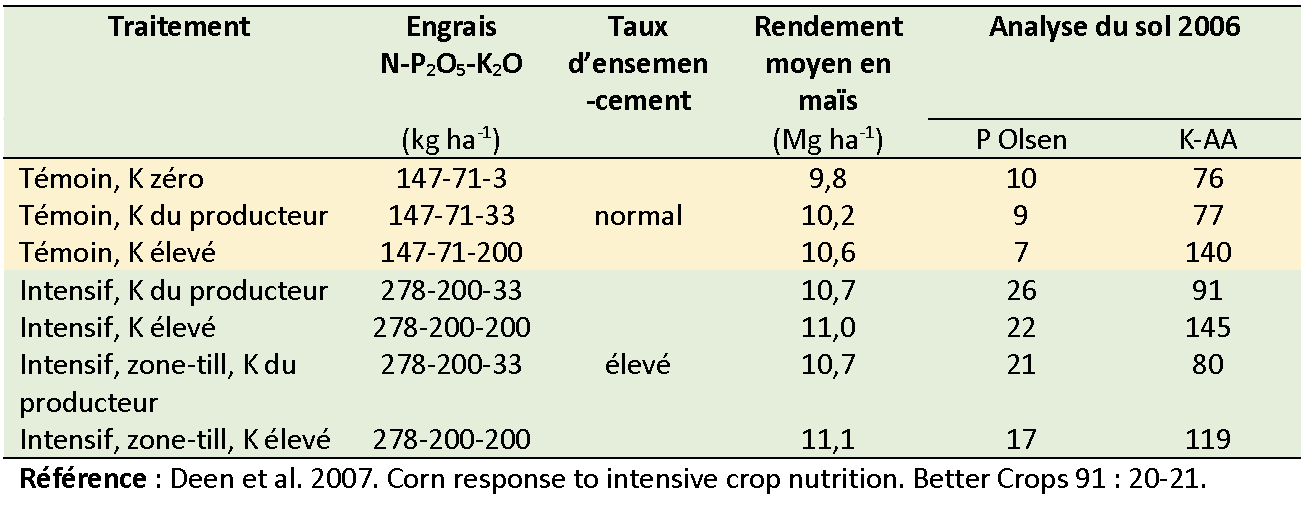 Les résultats d’analyses du sol portant sur le P et le K ont révélé qu’il y avait eu peu de changements là où les apports de P et de K correspondaient aux taux du producteur, mais qu’ils avaient augmenté de manière significative là où des taux supérieurs à ceux du producteur avaient été appliqués. Les taux du producteur ont entraîné des excédents nets de P et des déficits nets de K, bien que les changements n’aient pas été suffisamment importants pour influencer les résultats des analyses du sol. Ce qui n’a pas été le cas des résultats d’analyses de sol là où on avait appliqué des taux plus élevés de chaque élément, car les résultats ont montré des excédents de chacun élément. Cette expérience démontre que, pour rentabiliser le rendement des cultures, il faut répondre aux besoins en éléments nutritifs par des apports en quantité suffisante.
Les résultats d’analyses du sol portant sur le P et le K ont révélé qu’il y avait eu peu de changements là où les apports de P et de K correspondaient aux taux du producteur, mais qu’ils avaient augmenté de manière significative là où des taux supérieurs à ceux du producteur avaient été appliqués. Les taux du producteur ont entraîné des excédents nets de P et des déficits nets de K, bien que les changements n’aient pas été suffisamment importants pour influencer les résultats des analyses du sol. Ce qui n’a pas été le cas des résultats d’analyses de sol là où on avait appliqué des taux plus élevés de chaque élément, car les résultats ont montré des excédents de chacun élément. Cette expérience démontre que, pour rentabiliser le rendement des cultures, il faut répondre aux besoins en éléments nutritifs par des apports en quantité suffisante.
Le calcium est libéré par altération des minéraux primaires tels que l’anorthite (CaAl2Si2O3), suivi des pyroxènes et des amphiboles; de petites quantités de Ca résultent de l’altération de la biotite et de l’apatite. Des quantités substantielles de Ca2+ sont libérées par la dissolution de minéraux secondaires comme le calcaire (CaCO3), le calcaire dolomitique (CaMg(CO3)2) et le gypse (CaSO4⋅2H2O), qui sont tous des sources majeures de Ca2+ dans les sols canadiens.
Le magnésium dans les sols provient de roches telles que la biotite, la dolomie, la hornblende, l’olivine et la serpentine. Le magnésium est souvent un cation substitut dans les minéraux argileux, tels que la chlorite, l’illite, la montmorillonite et la vermiculite. L’altération des roches et des argiles libère du Mg2+ dans l’eau interstitielle du sol, tout comme en libère la dissolution des minéraux secondaires de Mg, tels que le calcaire dolomitique (CaMg(CO3)2), l’epsomite (MgSO4⋅7H2O) et la bloedite (Na2Mg(SO4)3⋅4H2O).
Il se crée un équilibre chimique entre la quantité de K+, de Ca2+ et de Mg2+ dans l’eau interstitielle du sol et la quantité de ces mêmes ions sur les sites d’échange de cations. De petits ions, en particulier l’ion H+, peuvent remplacer ces éléments minéraux sur les sites d’échange, ce qui mène à la désorption de K+, Ca2+ et Mg2+ dans l’eau interstitielle du sol. L’équilibre qui s’établit entre les ions minéraux échangeables et solubles est le facteur déterminant clé de la disponibilité du K+, du Ca2+ et du Mg2+ pour les plantes. Puisque le pH affecte la charge des surfaces organominérales (c.-à-d. que les sols neutres à alcalins ont des surfaces chargées plus négativement que les sols acides), la capacité d’échange est liée au pH du sol, à la teneur en argile et en matière organique.
Réactions qui diminuent le potassium, le calcium et le magnésium disponibles pour les plantes
Les ions K+, Ca2+ et Mg2+ sont retirés de l’eau interstitielle sol par des processus de nature biologique, chimique et physique. L’absorption biologique du K+ est essentielle dans l’activation enzymatique (plus de 80 enzymes nécessitent l’ion K+ comme cofacteur), les processus de transport et de régulation osmotique. Le Ca2+ dans les plantes a pour fonction de maintenir les membranes des cellules, de participer à leur division et à leur élongation. Le Mg2+ constitue non seulement un composant essentiel de la chlorophylle, mais aussi un composant structurel des ribosomes, en plus de jouer sa part dans les réactions de transfert auxquelles participent des groupes phosphates réactifs.
Les réactions d’adsorption s’inscrivent dans le processus chimique dominant qui extrait le K+, le Ca2+ et le Mg2+ de l’eau interstitielle du sol. L’adsorption peut se produire sur les surfaces externes (position « o »), les surfaces internes (position « i ») et le bord (positions « e ») des minéraux argileux. De plus, ces ions peuvent être adsorbés dans l’interréseau d’argiles 2:1 du mica, de l’illite et de la vermiculite. En raison de sa charge 1+ et de son petit rayon ionique, K+ a tendance à se lier dans l’interréseau, tandis que Ca2+ et Mg2+ restent sur les surfaces externes des minéraux argileux. Ces liaisons réduisent la quantité de l’ion K+ dans l’eau interstitielle du sol, en raison de la fixation du potassium par les minéraux argileux du type 2:1, phénomène qui peut représenter jusqu’à 20 % du K total contenu dans les sols. Les ions K+, Ca2+ et Mg2+ dans l’eau interstitielle du sol peuvent aussi se faire lessiver de la couche arable. Ce phénomène va de pair avec la lixiviation des anions, car pour maintenir la neutralité électrique, anions et cations s’accompagnent l’un l’autre dans l’eau interstitielle du sol. L’érosion des particules riches en argile est un autre processus qui réduit la concentration des ions échangeables K+, Ca2+ et Mg2+ de la couche arable.
Oligo-éléments
La plupart des oligo-éléments (fer, cuivre, manganèse, zinc, nickel, bore, molybdène) que l’on trouve dans un sol résultent de l’altération du matériau d’origine. Le chlore disponible pour les plantes se dissout à partir de sels tels que le NaCl et le KCl, ou il peut pénétrer dans le sol avec l’eau de pluie et d’irrigation. Les oligo-éléments se trouvent généralement concentrés dans la solution vasculaire et le cytoplasme des plantes; ils se retrouvent donc dans les résidus organiques et sont libérés lors de la fragmentation physique initiale de ceux-ci dans le processus de décomposition. Les résidus végétaux et animaux présentent de ce fait pour les plantes une source naturelle d’oligo-éléments. Chaque oligo-élément a des fonctions spécifiques dans les plantes, qui sont énumérées au tableau 7.6.
Tableau 7.6 Fonctions des oligo-éléments dans les plantes, d’après Jones (2003)
| Élément | Fonctions |
|---|---|
| Fer | Les protéines contenant du Fe, dont les protéines à hèmes et les protéines Fe-S, sont importantes pour la photosynthèse, la production de chlorophylle et la synthèse de l’acide ribonucléique. Les cytochromes sont des protéines hémiques contenant du Fe, la plus connue étant la ferrédoxine Fe-S. |
| Manganèse | Important dans les processus redox, notamment dans le transport des électrons dans la photosynthèse et la détoxification des radicaux libres de l’oxygène. Un co-facteur enzymatique dans la biosynthèse de métabolites secondaires tels que les composés phénoliques, les lignines et les flavonoïdes. |
| Cuivre | Les enzymes contenant du Cu réagissent avec l’O2 moléculaire; elles participent à la photosynthèse, la respiration, la détoxification des radicaux superoxydes et aux réactions de lignification. |
| Zinc | Un activateur d’enzymes qui améliore la liaison entre des enzymes et des substrats impliqués dans le métabolisme des glucides, la synthèse des protéines et la détoxification des radicaux superoxydes (O2-) de façon à mieux protéger les lipides membranaires et les protéines contre l’oxydation. |
| Nickel | Nécessaire au bon fonctionnement de l’enzyme uréase, qui catalyse la réaction CO(NH2)2 + H2O → 2 NH3 + CO2. Toute culture produisant des uréides a besoin de Ni. |
| Bore | Forme des complexes stables avec des composés organiques qui contribuent à la formation et à la stabilisation de la paroi cellulaire, à la lignification et à la différenciation du xylème. |
| Molybdène | Participant aux réactions de transfert d’électrons. Les enzymes contenant du Mo catalysent la fixation biologique N2; les enzymes jouent un rôle crucial dans la formation du pollen par les plantes. |
| Chlore | Anion mobile essentiel de l’osmorégulation (p. ex., l’élongation cellulaire, l’ouverture des stomates) et la compensation de charge (p. ex., les charges d’équilibre entre les cations et les anions dans le cytoplasme). Co-facteur essentiel de la photosynthèse. |
L’absorption des oligo-éléments par les plantes s’améliore avec l’augmentation de la température chez les plantes dotées d’un système racinaire prolifique; en effet l’augmentation de l’évapotranspiration qui vient avec l’augmentation de la température a pour effet d’attirer les formes hydrosolubles des oligo-éléments sur la surface des racines, qui n’ont plus qu’à les absorber. Le sol doit être suffisamment humide pour maintenir les ions des oligo-éléments dans l’eau interstitielle, mais pas trop humide, car cela pourrait créer des conditions anoxiques qui viendraient affecter le phénomène d’absorption des ions par les racines. Par exemple, les conditions anoxiques empêchent l’absorption de Fe2+ par les racines, mais peuvent augmenter l’absorption des ions toxiques Mn2+. Le pH du sol joue aussi un rôle critique. La quantité de fer, de cuivre, de manganèse, de zinc et de nickel disponibles pour les plantes diminue à mesure que le pH augmente jusqu’à la gamme neutre et alcaline. Par exemple, une carence en fer peut survenir chez des plantes poussant dans un sol calcaire dont le pH > 7,5. Les plantes s’adapteront à cet environnement en modifiant la morphologie de leurs racines pour augmenter la croissance des poils absorbants, libérer des protons pour acidifier la rhizosphère et rendre le Fe3+ plus soluble et réduire le Fe3+ en Fe2+ grâce à l’action d’une enzyme chélate réductase Fe3+ associée à la membrane plasmique et enfin transporter le Fe2+ à travers la membrane plasmique avec un transporteur régulé par le fer. Les plantes de la famille des Poacées ont une stratégie d’adaptation différente, au cours de laquelle les phytosidérophores procèdent à la chélation de Fe3+ avant que le complexe soluble de Fe3+ soit absorbé par les racines.
Les plantes ont besoin de beaucoup moins d’oligo-éléments que de macro-éléments (tableau 7.1). Les réserves du sol suffisent en général pour répondre aux besoins des plantes, en particulier dans les sols de pH 6 à 7 et lorsque l’on emploie des cultivars adaptés aux conditions du sol. On peut améliorer la nutrition en oligo-éléments en ajoutant de l’engrais contenant le(s) oligo-élément(s) déficient(s) dans le sol ou directement sur le feuillage des plantes. Dans le cas de l’application foliaire, on pulvérise sur le feuillage une petite quantité d’engrais d’oligo-éléments (qui baigne dans une solution avec un adjuvant (pour améliorer l’adhérence de la solution à la surface de la feuille pendant la croissance végétative des plantes ou de ses premiers stades de reproduction. Les oligo-éléments hydrosolubles tels que H3BO3, Cu2+, Mn2+, MoO4– et Zn2+ et les chélates solubles sont absorbés par les pores de la feuille et se déplacent dans le système vasculaire de la plante jusqu’aux organes et tissus où ils sont requis. La fertilisation foliaire est avantageuse, car elle apporte une petite quantité d’oligo-éléments tout en permettant d’éviter les réactions d’adsorption et de précipitation qui se produisent dans le sol. En raison de la sensibilité des cellules photosynthétiques dans les feuilles, on doit choisir avec grand soin le taux d’application et le moment de l’application des oligo-éléments sur le feuillage.
Éléments non essentiels
Les éléments non essentiels se répartissent en deux classes : (1) les éléments qui sont bénéfiques pour certaines plantes, mais pas toutes et (2) les éléments qui ne sont pas nécessaires à la croissance des plantes. Les éléments qui stimulent la croissance de certaines plantes comprennent le silicium, le sodium et le sélénium. Le silicium est bénéfique pour le riz, la canne à sucre et d’autres espèces de graminées. Il s’accumule préférentiellement dans les tissus de la tige et semble jouer un rôle dans le maintien de l’intégrité structurelle du système vasculaire, une caractéristique indispensable pour le transport de l’eau, des éléments nutritifs, des glucides et d’autres substances dans toute la plante. On associe des concentrations élevées de silicium à une meilleure tolérance à la sécheresse. L’application de sodium peut améliorer la croissance de certaines plantes C4 telles que le céleri, l’épinard, la betterave à sucre et le navet. Le sélénium semble avoir des avantages généraux liés à la tolérance au stress oxydatif et à une plus grande résistance aux dommages des tissus causés par les agents pathogènes et les herbivores.
Certains éléments peuvent être absorbés en quantité toxique pour les plantes. Dans les sols acides contenant des concentrations de 10 à 20 mg kg-1 ou plus d’Al3+ hydrosoluble, les plantes peuvent présenter une toxicité à l’aluminium. Le déclin des fonctions racinaires des plantes est lié aux dommages oxydatifs des membranes cellulaires, à la diminution de la division cellulaire et de l’allongement des cellules à leur extrémité de croissance en raison du remplacement du Ca2+ par l’Al3+. Chez les plantes sensibles, la présence d’Al3+ dans les tissus foliaires peut réduire la conductance stomatique et la teneur en chlorophylle, ce qui a pour effet de réduire le taux de photosynthèse. Les plantes cultivées dans des sols acides sont également sujettes à la toxicité du manganèse lorsqu’elles absorbent plus de Mn2+ que nécessaire pour assurer leurs fonctions métaboliques, ce qui entraîne un stress oxydatif et la destruction de l’acide indole-3-acétique (auxine), une hormone de croissance importante chez les plantes. Les symptômes de toxicité du manganèse devraient être plus graves dans les sols anoxiques, car la limitation d’oxygène réduira plusieurs composés à faible solubilité, tels que MnO2, Mn2O3 et Mn3O4, en Mn2+ soluble. Le chaulage des sols acides avec du CaCO3 ou avec une autre substance neutralisante qui augmente le pH du sol augmentera la quantité d’oxydes et d’hydroxydes, qui formeront des précipités avec Al3+ et Mn2+. Étant donné que les oxydes/hydroxydes d’aluminium précipités et les oxydes de manganèse ne sont pas solubles dans l’eau, le risque de toxicité pour les plantes diminue avec l’augmentation du pH du sol. L’installation de systèmes de drainage qui augmentent le taux d’oxygène dans le sol devrait réduire la toxicité du Mn2+ chez les plantes.
Dans les sols salins, l’abondance de sodium (Na+), de SO42- ou de Cl- crée un stress salin pour les plantes. En raison de l’osmose, les cellules racinaires ont tendance à perdre de l’eau lorsque les teneurs en Na+, en SO42- et en Cl– sont plus élevées à l’extérieur qu’à l’intérieur de la racine. Cela peut entraîner des troubles physiologiques dans les racines et d’autres tissus végétaux, tels qu’une toxicité ionique, des processus métaboliques altérés, un stress oxydatif, une rupture de la membrane et moins de division et d’expansion cellulaires. Par conséquent, les plantes ont besoin de plus d’eau pour croître dans les sols salins. La transpiration est responsable du mouvement de l’eau et de l’accumulation de sels hydrosolubles près des racines. L’évaporation provoque également le mouvement du sel dans la couche arable, en particulier sous les climats semi-arides et arides où la perte d’eau annuelle est supérieure aux précipitations annuelles. Il est possible d’éliminer l’excès de Na+ et de Cl– de la zone racinaire par la mise en application d’une bonne gestion du sol. L’irrigation par aspersion combinée à l’amélioration du drainage pourrait lessiver ces sels à travers le profil du sol et les éloigner des racines des plantes. On devrait employer des plantes tolérantes au sel dans des sols salins.
STRATÉGIE DE GESTION DES ÉLÉMENTS NUTRITIFS DU SOL
Dans les exploitations agricoles, on ne saurait parler de fertilité du sol sans que l’on connaisse d’abord son état de fertilité, état que l’on doit évaluer à partir d’observations sur la croissance des plantes, de mesures de rendement, d’analyses de tissus végétaux et de tests de fertilité du sol, et ce, pour chaque champ. Dans cette évaluation diagnostique de la fertilité du sol, on doit aussi tenir compte d’autres facteurs qui l’influencent : (1) quantité de résidus de culture laissée au champ après récolte, (2) quantité et fréquence d’épandage de chaux agricole et autres amendements du sol, (3) quantité d’engrais appliquée annuellement. On doit également considérer le type de cultures (p. ex., en rotation ou pas), le travail du sol, les conditions d’irrigation et de drainage de chaque champ. Cette information peut expliquer pourquoi la matière organique du sol et les concentrations en éléments nutritifs augmentent, se stabilisent ou diminuent dans l’ensemble d’une exploitation agricole.
Bien qu’il soit tentant de croire que l’on devrait toujours essayer d’augmenter les teneurs en matière organique et en éléments nutritifs dans un sol, cela n’est pas toujours réalisable ou souhaitable. Il existe des limites physiques dans la capacité d’un sol à retenir de la matière organique, capacité qui est liée aux conditions climatiques (principalement la température et les précipitations); ces deux conditions sont déterminantes dans ce qu’il reste de résidus de culture après la récolte, dans l’activité microbienne du sol et dans la texture du sol. L’augmentation de la concentration d’éléments nutritifs hydrosolubles dans un sol à fertilité élevée ou excessivement élevée pourrait faire augmenter le risque de perte d’éléments nutritifs de cet environnement par des réactions biologiques (p. ex., perte d’azote sous des formes gazeuses telles que NH3, N2O et N2) et par lessivage et érosion, ces derniers transportant le NO3– et le H2PO4– soluble et les éléments nutritifs associés aux particules en aval. Par conséquent, il faut savoir employer les engrais et autres amendements avec prudence et discernement.
L’importance de mesurer le nitrate résiduel du sol pour évaluer l’efficacité d’utilisation de l’azote
Le nitrate résiduel du sol à la fin de la saison de croissance représente le N qui n’a pas été utilisé par la culture. Ainsi, mesurer la quantité de nitrate demeure dans le sol après la récolte est un moyen d’évaluer l’efficacité de la gestion des sources de N. Sous les climats semi-aride et subhumide, cette mesure est employée afin d’ajuster les besoins en fertilisants azotés pour la prochaine saison de culture. Cependant, dans les systèmes agronomiques sous climat frais et humide, où le risque potentiel est important de perdre du nitrate en-dehors de la saison de croissance, la mesure du nitrate résiduel du sol est un indicateur de la perte de nitrate vers le milieu aquatique. Dans la série sur les indicateurs agroenvironnementaux d’Agriculture et Agroalimentaire Canada (Clearwater et coll., 2016), la différence entre les intrants et les sorties en N est mesurée par l’indice d’azote résiduel dans le sol. Celui-ci a été estimé dans les régions agricoles au Canada (voir figure ci-dessous).
Cet indicateur montre le potentiel d’une grande quantité d’azote résiduelle dans le sol à l’automne après les récoltes dans l’Est du Canada, avec des valeurs typiques excédant 40 kg N ha-1. L’inventaire récent des nitrates – mesurés à une profondeur de 45 cm dans le sol – à l’Île-du-Prince-Édouard suggère que cette estimation est conservatrice pour la production de pomme de terre où l’on observe des valeurs moyennes dépassant les 60 kg N ha-1. La mise en œuvre des pratiques 4B a permis de réduire jusqu’à 30 % l’azote résiduel dans le sol à l’ÎPÉ.
Étant donné que l’on s’attend à ce que ce soit les cultures qui bénéficient des éléments nutritifs d’un sol et non des plantes indésirables, on doit s’efforcer d’appliquer les engrais de manière à ce que ce soit les cultures qui les prélèvent. L’approche de gestion des éléments nutritifs 4B fait reposer l’utilisation des engrais sur une sélection guidée des « bonnes actions » à prendre. En voici quelques-unes :
- Savoir choisir, pour une culture donnée, la bonne source d’engrais, soit une qui libérera des éléments nutritifs hydrosolubles. La bonne source d’engrais est celle qui est disponible à un coût abordable. Par exemple, le fumier et le compost sont deux engrais produits à la ferme, disponibles et peu coûteux. Pour répondre aux besoins en éléments nutritifs d’une culture donnée, on conseille d’appliquer d’abord ces engrais et n’acheter des engrais du commerce que si les premiers ne contiennent pas tous les éléments nutritifs requis pour la plante cultivée. Peut-on faire usage d’un engrais à libération rapide pour corriger une culture qui montre une carence en un élément nutritif donné ? Préférer une source d’engrais qui se dissout dans l’eau. Un engrais à libération lente, biologiquement ou géochimiquement stabilisé qui libère lentement des éléments nutritifs hydrosolubles, pourrait convenir aux cultures annuelles à longue période de croissance ou aux cultures vivaces.
- Choisir le bon taux d’engrais qui permettra à la culture d’atteindre son rendement optimum. Dans la détermination du taux, tenir compte de l’apport des éléments nutritifs résiduels provenant des résidus de culture en décomposition et du fumier animal qui ont été appliqués au cours des saisons précédentes. L’application de plus d’éléments nutritifs que ce qu’une culture peut en utiliser n’améliorera pas son rendement, mais pourra en revanche faire croître davantage les mauvaises herbes. Du point de vue économique, il est préférable d’appliquer un peu moins d’engrais que nécessaire, en particulier lorsque les conditions de croissance sont sous-optimales en raison d’un printemps froid, d’une inondation ou d’une sécheresse. L’application de plus d’engrais pendant une mauvaise saison de croissance n’améliorera pas la croissance de la culture, mais constituera plutôt un gaspillage d’argent.
- Choisir le bon moment pour appliquer l’engrais afin de pouvoir synchroniser l’apport d’éléments nutritifs hydrosolubles avec les périodes de forte demande en éléments nutritifs de la culture. Les cultures annuelles ont une phase de croissance végétative exponentielle qui dure plusieurs semaines, qui ralentit après l’initiation florale. Dans les sols humides et irrigués, la meilleure stratégie consiste à appliquer l’engrais juste avant la phase de croissance exponentielle, afin que les plantes absorbent efficacement les éléments nutritifs. Dans le cas de certaines cultures, on doit appliquer l’engrais au début de la phase de reproduction pour favoriser le développement de semences de haute qualité. Cependant, appliquer les engrais appropriés au début de la saison de croissance se révèle une meilleure stratégie dans les régions semi-arides et subhumides, car la libération des éléments nutritifs est lente lorsque les précipitations se produisent de manière inégale pendant la croissance végétative et les premiers stades de reproduction. Les cultures vivaces peuvent être fertilisées avant qu’elles se remettent à croître l’année suivante. Les fourrages vivaces (c.-à-d. les champs de foin) qui sont récoltés deux, trois ou quatre fois par an peuvent être fertilisés après chaque coupe successive, avant qu’elles se remettent à pousser.
- Appliquer l’engrais au bon endroit pour que les racines des plantes absorbent au maximum des éléments nutritifs hydrosolubles. L’emplacement de l’application de l’engrais est crucial; suffisamment éloigné des graines et les semis pour éviter tout contact direct des sels d’engrais avec eux, mais suffisamment proches pour ne pas que les éléments nutritifs hydrosolubles soient lessivés de la zone racinaire avant que les poils absorbants n’aient eu le temps de les absorber. Le mode de placement des engrais le plus efficace dans le cas des cultures annuelles consiste à placer l’engrais dans la rangée plantée (c.-à-d. entre les graines ou les tubercules) ou à côté de la rangée plantée de sorte que la transpiration facilite le mouvement des ions nutritifs par débit massique (p. ex., NO3–, SO42-) et par diffusion (p. ex., H2PO4–, K+). À mesure que les engrais se dissolvent ou se minéralisent, ils libèrent des éléments nutritifs solubles, les rendant accessibles au système racinaire en développement. On peut aussi traiter les graines avec de l’engrais, tant que sa teneur en sels ne dépasse pas le seuil à partir duquel les sels provoqueraient du stress osmotique pendant la germination ou le développement des plantules. L’application foliaire est un moyen rapide d’apporter de petites quantités de certains engrais à base d’oligo-éléments, mais la prudence est de mise, car la frontière est mince entre la dose qui comblera une carence et celle qui empoisonnera la plante.
Les principes de gestion des éléments nutritifs 4B posent les fondements de la gestion des éléments nutritifs dans les exploitations agricoles, mais doivent être combinés avec des pratiques de conservation des sols et de l’eau pour être efficaces. Le cadre 4B Plus mis en application dans les exploitations agricoles modernes intègre les pratiques de conservation des sols et de l’eau à la gestion des éléments nutritifs 4B. L’objectif de l’approche 4B Plus est de fournir des éléments nutritifs aux cultures en fonction de leur besoin et d’améliorer la fertilité des sols et la qualité de l’eau. Les pratiques de conservation des sols et de l’eau qui peuvent améliorer la fertilité des sols et la gestion des éléments nutritifs comprennent :
- Réduire le travail du sol pour minimiser la perturbation du sol et maintenir sa structure.
- Conserver les résidus de culture à la surface du sol pour le protéger de l’impact des précipitations.
- Recourir aux cultures de couverture pour protéger le sol et soutenir sa communauté microbienne entre les saisons de culture.
- Appliquer les principes 4B à l’application des engrais et du fumier : choisir la bonne source et la bonne dose d’engrais et l’appliquer au bon endroit au bon moment.
- Valoriser les applications de fumier pour améliorer la biologie et la fertilité du sol.
- Limiter la circulation au champ pour réduire le compactage du sol.
- Instaurer le mode des rotations des cultures et inclure des cultures vivaces qui enrichissent le sol en matière organique.
- Établir des bandes tampons de contours, des zones tampons au champ et des zones tampons près des cours d’eau pour protéger les milieux sensibles sur le lieu de production même et en aval.
- Les zones très vulnérables à l’érosion peuvent être couvertes de cultures vivaces ou d’arbres plutôt que de cultures annuelles.
- Ne recourir qu’à du pâturage visé par règlement ou en rotation pour minimiser l’érosion du sol.
Impact du travail du sol à long terme et de l’application de fertilisants synthétiques sur les caractéristiques du sol et sur les rendements des cultures dans le cadre d’une rotation maïs-soja dans l’Est canadien
Dans l’Est canadien, la rotation maïs (Zea mays L.)- soja [Glycine max (L.) Merr.] représente une association céréale-légumineuse dominante. Bien que les avantages économiques de cette rotation soient reconnus, il demeure nécessaire d’évaluer son impact à long terme sur la qualité du sol et sur la productivité des cultures au regard de diverses possibilités de gestion comme réduire le travail du sol ou varier les taux d’engrais de synthèse. En effet, le rôle fondamental des expériences de terrain à long terme qui visent l’évaluation des effets des pratiques de gestion sur la fertilité et la qualité des sols et la productivité des cultures est reconnu comme essentiel depuis des décennies par la communauté scientifique internationale.
En 1992, on a mis en place un dispositif de recherche à long terme dans le sud du Québec sur un sol de texture loam argileux dans le but d’évaluer les effets (1) du travail du sol [charrue conventionnelle à versoir (CV) par rapport au semis direct (SD)], (2) de l’ajout de N de synthèse (0, 80 et 160 kg N ha-1) et (3) de la fertilisation en P (0, 17,5 et 35 kg P ha-1) sur le fonctionnement du sol et les rendements d’une séquence de culture maïs-soja. Les engrais de synthèse ont été appliqués uniquement à la phase maïs de la rotation, tandis que le travail du sol a été effectué chaque année.
Les résultats obtenus 12 à 20 ans après le début de l’étude ont indiqué que le traitement SD avait amélioré l’accumulation de C organique, la disponibilité de NO3-N, P et K et l’activité microbienne dans la couche supérieure du sol, probablement en raison de l’accumulation des résidus de culture à la surface du sol ou près d’elle. L’accumulation de ces résidus peut favoriser la structure du sol, mais pourrait en revanche créer un impact défavorable sur la qualité des eaux de surface à long terme. À l’inverse, l’application du traitement CV a eu pour effet de distribuer uniformément le C organique et les éléments nutritifs jusqu’à la profondeur du travail du sol et de favoriser l’activité microbienne à cette profondeur. De fortes relations ont été établies entre les tests du P du sol (par ex., Mehlich 3 et P de Olsen) et le bilan du P; elles révèlent le mode d’accumulation du P en fonction du temps et de l’application de pratiques agricoles continues. Les émissions de N2O du sol ont augmenté avec l’ajout d’engrais de N dans la culture du maïs, mais elles n’ont pas été influencées par le travail du sol. Le rendement « maïs-grain » a réagi de façon linéaire à l’ajout d’engrais d’azote toutes les années, mais le rendement du soja a été peu influencé par l’azote résiduel. À l’exception de l’état du P du sol, le P des engrais a eu un impact limité sur les deux cultures dans cette expérience, mais on a estimé que le manque de réapprovisionnement conduirait éventuellement à l’épuisement du P du sol. Dans l’ensemble, les rendements découlant du traitement CV ont été supérieurs à ceux découlant du traitement SD durant plusieurs années (voir figure ci-dessus) (il n’y pas de figure dans la version anglaise, ni ici) – en moyenne de +10 % en maïs et +13 % en soja – de même qu’ils ont été plus rentables. La performance inférieure du traitement au SD dans cette expérience par rapport au traitement CV est que ce dernier a contribué à apporter un supplément de fraicheur et d’humidité par les résidus de culture laissés en surface.
Remarque : cette expérience est toujours en cours; d’autres études sont en cours. Pour obtenir plus de détails, voir Ziadi et coll. (2014).
À l’avenir, les gestionnaires de la fertilité des sols s’appuieront davantage sur les technologies d’agriculture de précision pour atteindre les objectifs des 4B Plus. Le plus grand avantage de l’agriculture de précision, du point de vue de la gestion des éléments nutritifs, est qu’elle permet le développement de cartes spatialement explicites des conditions pédologiques et hydrologiques des champs agricoles. Les multiples couches d’information que produisent ces cartes permettent d’évaluer les caractéristiques propres à un champ donné, telles que le pH du sol ou sa concentration en potassium, ou d’évaluer les interactions entre plusieurs caractéristiques (p. ex., les changements du pH du sol associés aux fluctuations du niveau de la nappe phréatique observée dans l’étendue du champ). Plutôt que de compter sur une seule valeur moyenne de fertilité du sol pour tout un grand champ, on peut observer les gradients de fertilité du sol qui le caractérisent. Connaître les zones de fertilité faible, moyenne et élevée permet d’ajuster les taux d’application d’engrais pour répondre aux besoins de la culture en croissance dans une zone particulière, plutôt que d’appliquer un taux d’engrais uniforme sur tout le champ. Les cartes pédologiques et hydrologiques peuvent également permettre de déterminer les zones vulnérables dans les champs où le lessivage ou l’érosion risquent de se produire davantage qu’ailleurs. Ainsi, une exploitation agricole qui adopte des technologies d’agriculture de précision peut économiser de l’argent en appliquant des engrais avec précision, là où ils sont nécessaires, et établir des zones tampons autour des zones sensibles des champs et à l’interface entre les champs cultivés et les terres non agricoles. Les technologies d’agriculture de précision sont bien alignées sur les objectifs 4B Plus et devraient être très utiles pour la gestion de la fertilité des sols à l’avenir.
SOMMAIRE
- Les ions nutritifs hydrosolubles logés dans les pores du sol sont absorbés par les poils absorbants des plantes.
- Les éléments nutritifs disponibles pour les plantes dans l’eau interstitielle du sol peuvent être transformés en formes indisponibles qui résultent de processus de nature biologique, comme l’absorption par les plantes, l’immobilisation par les tissus microbiens et la réduction. Dans les processus de nature chimique, on compte les réactions chimiques de précipitation et d’adsorption qui font également diminuer la quantité d’éléments nutritifs disponibles dans l’eau interstitielle du sol. Les processus de nature physique englobent les phénomènes de lessivage et d’érosion du sol, deux causes de perte « physique » d’éléments nutritifs disponibles pour les plantes.
- L’eau interstitielle du sol est réapprovisionnée en éléments nutritifs disponibles par les réactions de minéralisation, d’oxydation, d’altération, de dissolution et de désorption.
- Les tests de fertilité du sol permettent de quantifier l’apport du sol en éléments nutritifs : ces tests fournissent de l’information nécessaire aux recommandations de fertilisation. On détermine les besoins d’une culture en éléments nutritifs à partir des résultats d’analyses des tissus végétaux afin de savoir si elle en a suffisamment ou pas pour assurer un rendement économiquement optimal.
- On peut appliquer des engrais inorganiques et organiques dans le but de réapprovisionner un sol en éléments nutritifs et ainsi améliorer la nutrition des cultures. La dissolution des engrais inorganiques libère rapidement des ions nutritifs solubles dans l’eau, tandis que les engrais organiques contiennent des composés organiques qui nécessitent d’être minéralisés pour qu’ils libèrent des ions nutritifs solubles, ce qui en fait des engrais à libération relativement lente.
- L’approche de gestion des éléments nutritifs 4B du sol incite à l’adoption de bonnes habitudes : sélecter la bonne source d’engrais, l’appliquer au bon taux au bon moment et au bon endroit de façon à ce que le maximum d’éléments nutritifs contenus dans les engrais se retrouve dans la biomasse des cultures. L’objectif est d’atteindre d’une manière rentable une bonne efficacité de l’utilisation des éléments nutritifs des engrais.
- Les éléments nutritifs du sol risquent d’être perdus du système sol-plante; on doit donc gérer de façon consciente ce risque, car les pertes peuvent être préjudiciables à l’environnement.
- Les encadrés « Matière à réflexion » donnent des exemples d’analyses de fertilité du sol et de réapprovisionnement des sols canadiens en éléments nutritifs.
LECTURE SUGGÉRÉE
International Plant Nutrition Institute. 2012. 4R plant nutrition: a manual for improving the management of plant nutrition. North American version. IPNI, Norcross, GA, USA.
Havlin, J.L., J.D. Beaton, S.L. Tisdale, and W.L. Nelson. 2014. Soil fertility and fertilizers: an introduction to nutrient management. 8th ed. Pearson Prentice Hall, Upper Saddle River, NJ.
Munroe, J. (ed). 2016. Soil fertility handbook. 3rd edn. Ontario Ministry of Agriculture, Food and Rural Affairs Publication 611. Queen’s Printer for Ontario, Toronto. http://www.omafra.gov.on.ca/english/crops/pub611/pub611.pdf
Reid, K. 2014. Improving your soil: A practical guide to soil management for the serious home gardener. Firefly Books Ltd., Richmond Hill, Ontario, 272 p.
EXERCICES PRATIQUES
- Comment les éléments nutritifs du sol sont-ils absorbés par les plantes ?
- Remplir le tableau suivant.
Élément nutritif Macro-ou oligo-élément ? ource dans le sol ? Rôle dans la nutrition des plantes N P Ca S Cu Fe - Donnez un exemple de réaction biologique qui peut diminuer dans l’eau interstitielle du sol et la quantité d’azote disponible pour les plantes.
- Comment appelle-t-on la réaction chimique qui réduit la quantité de potassium assimilable par les plantes dans l’eau interstitielle du sol ?
- Pourquoi l’application d’un engrais contenant du NH3 tend à acidifier le sol ?
- L’azote est souvent l’élément nutritif qui limite l’atteinte du rendement optimum des cultures agricoles; est-ce donc une bonne idée d’ajouter aux sols agricoles des taux excessifs d’engrais azotés ? Justifiez votre réponse.
- Quel est l’outil de diagnostic qui déterminerait le mieux les besoins en engrais des cultures : test de fertilité du sol ou analyse des tissus végétaux ?
- Des engrais d’oligo-éléments peuvent être appliqués sur le feuillage des cultures. Quel est l’avantage d’utiliser cette méthode de fertilisation ?
- Quels paramètres faut-il considérer dans le choix de la source d’engrais la plus appropriée pour une culture donnée ?
RÉFÉRENCES
Abdi, D., Cade-Menun, B.J., Ziadi, N., and Parent, L.-É. 2014. Long-term impact of tillage practices and phosphorus fertilization on soil phosphorus forms as determined by 31P nuclear magnetic resonance spectroscopy. J. Environ. Qual. 43(4): 1431–1441.
Bender, R.R., J.W. Haegele, M.L. Ruffo, and F.E. Below. 2010. Nutrient uptake, partitioning, and remobilization in modern, transgenic insect-protected maize hybrids. Agron. J. 105(1): 161–170.
Carter, M.R. and Gregorich, E.G. 2008. Soil sampling and methods of analysis. 2nd ed. Canadian Society of Soil Science. CRC Press, Boca Raton, FL.
Centre de référence en agriculture et agroalimentaire du Québec. 2010. Guide de référence en fertilisation. 2e édn. Centre de référence en agriculture et agroalimentaire du Québec, Ste Foy, QC.
Chantigny, M.H., Angers, D.A., Morvan, T., and Pomar, C. 2004. Dynamics of pig slurry nitrogen in soil and plant as determined with N-15. Soil Sci. Soc. Am. J. 68(2): 637–643.
Deen, B., Lauzon, J., and Bruulsema, T. 2007. Corn response to intensive crop nutrition. Better Crops 91: 20–21. http://www.ipni.net/publication/bettercrops.nsf/issue/BC-2007-2
Dessureault-Rompré, J., Zebarth, B.J., Chow, T.L., Burton, D.L., Sharifi, M., Georgallas, A., Porter, G., Moreau, G., Leclerc, Y., Arsenault, W.J., and Grant, C.A. 2011. Prediction of soil nitrogen supply in potato fields in a cool humid climate. Soil Sci. Soc. Am. J. 75(2): 626–637.
Drury, C.F., Yang, J., De Jong, R., Huffman, T., Reid, K., Yang, X., Bittman, S., and Desjardins, R. 2016. Residual Soil Nitrogen. Pages 114–120 In R.L. Clearwater, T. Martin, and T. Hoppe (Eds.) Environmental Sustainability of Canadian Agriculture: Agri-Environmental Indicators Report Series. Report #4. Ottawa, ON: Agriculture and Agri-Food Canada
Elbon A., and Whalen, J.K. 2015. Phosphorus supply to vegetable crops from vesicular arbuscular mycorrhizae: a review. Biol. Agric. Hort. 31(2): 73–90.
Eskin, N., Vessey, K., and Tian, L. 2014. Research progress and perspectives of nitrogen fixing bacterium, Gluconacetobacter diazotrophicus, in monocot plants. Int. J. Agron. 2014, 13 p. Article 208383. https://doi.org/10.1155/2014/208383
Evans, J.R. 1989. Photosynthesis and nitrogen relationships in leaves of C3 plants. Oecologia 78(1): 9–19.
Fleury, D. 2020. 4R nitrogen management for wheat and canola. Top Crop Manager 19 August 2020 https://www.topcropmanager.com/4r-nitrogen-management-for-wheat-and-canola/
Follett, R.H., Murphy, L.S., and Donahue, R.L. 1981. Fertilizers and soil amendments. Prentice-Hall, Inc., Englewood Cliffs, NJ.
Havlin, J.L., Beaton, J.D., Tisdale, S.L., and Nelson, W.L. 2014. Soil fertility and fertilizers: an introduction to nutrient management. 8th ed. Pearson Prentice Hall, Upper Saddle River, NJ.
He, Z.Q., Honeycutt, C.W., Griffin, T.S., Cade-Menun, B.J., Pellechia, P.J., and Dou, Z.X. 2009. Phosphorus forms in conventional and organic dairy manure identified by solution and solid state P‐31 NMR spectroscopy. J. Environ. Qual. 38(5): 1909–1918.
International Plant Nutrition Institute. 2012. 4R plant nutrition: a manual for improving the management of plant nutrition. North American version. IPNI, Norcross, GA, USA.
Jones, J.B., Jr. 2003. Agronomic handbook: management of crops, soils and their fertility. CRC Press, Boca Raton, FL.
Karamanos, R.E. 2008. Nitrogen and phosphorus recommendations for Manitoba for today’s production costs. Presented at the 2008 Manitoba Agronomists Conference, Winnipeg, MB
http://umanitoba.ca/faculties/afs/MAC_proceedings/proceedings/2008/Regis%20Karamanos %20paper.pdf
Kour, D. Rana, K.L., Kaur, T., Yadav, N., Yadav, A.N., Kumar, M., Kumar, V., Dhaliwal, H.S., and Saxena, A.K. 2021. Biodiversity, current developments and potential biotechnological applications of phosphorus-solubilizing and -mobilizing microbes: A review. Pedosphere 31(1): 43–75.
Kumar, V., Vogelsang, L., Schmidt, R.R., Sharma, S.S., Seidel, T., and Dietz, K.-J. 2020. Remodeling of root growth under combined arsenic and hypoxia stress is linked to nutrient deprivation. Frontiers in Plant Science. 23 October 2020. https://doi.org/10.3389/fpls.2020.569687
Leytem, A.B., Smith, D.R., Applegate, T.J., and Thacker, P.A. 2006. The influence of manure phytic acid on phosphorus solubility in calcareous soils. Soil Sci. Soc. Am. J. 70(5): 1629–1638.
Marty, C., Lévesque, J.-A., Bradley, R.L., Lafond J., and Paré, M.C. 2019. Contrasting impacts of two weed species on lowbush blueberry fertilizer nitrogen uptake in a commercial field. PLoS ONE 14: e0215253.
Mehlich, A. 1984. Mehlich-3 soil test extractant: a modification of Mehlich-2 extractant. Commun. Soil Sci. Plant Anal. 15(12): 1409–1416.
Mortvedt, J.J., Cox, F.R., Shuman, L.M., and Welch, R.M. 1991. Micronutrients in agriculture. SSSA Book Series 4, American Society of Agronomy, Madison, WI.
Munroe, J. (ed). 2016. Soil fertility handbook. 3rd edn. Ontario Ministry of Agriculture, Food and Rural Affairs Publication 611. Queen’s Printer for Ontario, Toronto. http://www.omafra.gov.on.ca/english/crops/pub611/pub611.pdf
Ontario Ministry of Agriculture, Food and Rural Affairs (OMAFRA). 2006. Nutrient management planning. Best Management Practices Series, Guelph, ON.
Rascio, N., and La Rocca, N. 2013. Biological nitrogen fixation. Reference Module in Earth Systems and Environmental Sciences. Elsevier, Amsterdam. doi:10.1016/B978-0-12-409548-9.00685-0
Reid, R., and Hayes, J. 2003. Mechanisms and control of nutrient uptake in plants. Int. Rev. Cytol. 29: 73–114. doi: 10.1016/s0074-7696(03)29003-3.
Ruiz Herrera, L.F., Shane, M.W., and López-Bucio, J. 2015. Nutritional regulation of root development. WIREs Dev. Biol. 4: 431–443. doi: 10.1002/wdev.183
Sims, J.T., Maguire, R.O., Leytem, A.B., Gartley, K.L., and Pautler, M.C.. 2002. Evaluation of Mehlich 3 as an agri-environmental soil phosphorus test for the Mid-Atlantic United States of America. Soil Sci. Soc. Am. J. 66(6): 2016–2032.
Stumborg, C., Schoenau, J.J., and Malhi, S.S. 2007. Nitrogen balance and accumulation pattern in three contrasting prairie soils receiving repeated applications of liquid swine and solid cattle manure. Nutr. Cycl. Agroecosyst. 78: 15–25.
Westerman, R.L. 1990. Soil testing and plant analysis. 3rd edn. SSSA Book Series 3, American Society of Agronomy, Madison, WI.
Whalen, J.K. 2014. Managing soil biota-mediated decomposition and nutrient mineralization in sustainable agroecosystems. Advances in Agriculture 2014: 13 p. Article 384604. doi: 10.1155/2014/384604
Whalen, J.K., Thomas, B.W. and Sharifi, M. 2019. Novel practices and smart technologies to maximize the nitrogen fertilizer value of manure for crop production in cold humid temperate regions. Adv. Agron. 153: 1–85.
Zebarth, B.J., Leclerc, Y., Moreau, G., Gareau, R., and Milburn, P.H. 2003. Soil inorganic nitrogen content in commercial potato fields in New Brunswick. Can. J. Soil Sci. 83(4): 425–429.
Ziadi, N., Angers, D.A., Gagnon, B., Lalande, R., Morel, C., Rochette, P., and Chantigny, M.H. 2014. Long-term tillage and synthetic fertilization affect soil functioning and crop yields in a corn–soybean rotation in eastern Canada. Can. J. Soil Sci. 94 (3): 365–376.
Ziadi, N., Simard, R.R., Allard, G., and Lafond, J. 1999. Field evaluation of anion exchange membranes as a N soil testing method for grasslands. Can. J. Soil Sci. 79(2): 281–294.
About the Authors
Joann K. Whalen, professeure James McGill à l’Université McGill et professeure adjointe à la Gansu Agricultural University et au Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences

Joann a reçu son B.Sc. (Agronomie) de l’Université Dalhousie, sa M.Sc. de l’Université McGill et son Ph. D. de l’Ohio State University (États-Unis). Elle est agronome professionnelle (agronome) au Québec, Canada. Ses recherches portent sur la fertilité et l’écologie des sols dans les agroécosystèmes. Elle a publié plus de 230 articles scientifiques révisés par des pairs et supervisé/co-supervisé plus de 70 étudiants à la M.Sc., au Ph. D. et au postdoctorat. Elle enseigne la fertilité du sol, la planification de la gestion des éléments nutritifs et la chimie environnementale des sols.
Joann est rédactrice en chef de Soil Biology and Biochemistry, une revue universitaire qui publie des articles de recherche originaux et scientifiquement stimulants d’importance internationale qui décrivent et expliquent les processus biologiques se produisant dans les sols. Elle est membre de la Soil Science Society of America et de la Société canadienne des sciences du sol. Joann est la première scientifique internationale qui a été élue pour un mandat de 3 ans à titre de présidente de l’American Society of Agronomy (2022-2024). Elle a grandi dans une communauté agricole près de Sussex, au Nouveau-Brunswick, et s’est toujours intéressée aux aspects pratiques de la culture d’aliments. À son avis, les agronomes sont les mieux placés pour s’occuper de fertilité du sol, car ils disposent des connaissances dans les nombreux domaines- physique, hydrologie, chimie, biochimie, biologie végétale, microbiologie et génétique- qui leur permettent de comprendre les processus complexes et dynamiques du sol en cause dans la croissance des cultures. « Pour trouver un sens aux réactions du sol, dit-elle, nous devons creuser plus profondément », ce qui est tout à fait approprié pour un chercheur en science du sol !
Noura Ziadi, chercheuse scientifique, Agriculture et Agroalimentaire Canada; professeure associée à l’Université Laval, au Graduate University of Chinese Academy of Science et à l’Université du Québec en Abitibi-Témiscamingue

Noura poursuit une carrière en science du sol, en particulier sur la fertilité et la nutrition des plantes. Elle mène ses recherches à l’échelle nationale et internationale (France, Chine, Suisse, Finlande, Tunisie, Iran, Arabie Saoudite) au sein d’équipes multidisciplinaires, qui comprennent autant des chercheurs gouvernementaux et universitaires ainsi que que des partenaires industriels. Elle a publié plus de 155 articles, cinq critiques et 11 chapitres de livres, dont 37 articles dans la Revue canadienne de la science du sol [Canadian Journal of Soil Science (CJSS)]. Noura s’est jointe à la SCSS en 1994 et en a été la conseillère de l’Est (2008-2010), présidente désignée (2017), présidente (2018), puis présidente sortante (2019). Elle est éditrice associée (ÉA) pour la CJSS depuis 2011, a traité 107 manuscrits pour cette revue et a été reconnue comme meilleure ÉA en 2017. Elle a été reconnue pour ses contributions à la science du sol et à la SCSS par l’attribution d’une bourse de perfectionnement en 2015.
Jeff J. Schoenau, professeur et titulaire de la chaire de recherche du ministère de l’Agriculture de la Saskatchewan – Cycle et gestion des éléments nutritifs, Département des sciences du sol, Université de la Saskatchewan

Jeff est professeur de fertilité du sol et agronome professionnel au Département des sciences du sol de l’Université de la Saskatchewan. Il est titulaire de la Chaire de gestion des éléments nutritifs du sol du ministère de l’Agriculture de la Saskatchewan au Collège de l’agriculture et des bioressources et est membre de l’Institut agricole du Canada. Il est né en Saskatchewan, a obtenu ses diplômes de premier cycle et d’études supérieures dans les années 1980 au Collège d’agriculture de l’Université de la Saskatchewan et y travaille depuis. Il exploite également une ferme avec sa conjointe Lynne près de Central Butte, en Saskatchewan. Ses activités de recherche, d’enseignement et de vulgarisation portent sur la fertilité des sols et les engrais, le cycle des éléments nutritifs et les pratiques de gestion des sols dans les cultures des prairies.
Maxime C. Paré, professeur, Université du Québec à Chicoutimi (UQAC)

Maxime enseigne la science du sol à des étudiants de premier cycle, dont la plupart sont inscrits au programme de biologie de l’UQAC. Il enseigne la science du sol en les initiant aux différents domaines qu’elle couvre : chimie du sol, biologie du sol, cycle des éléments nutritifs et pédologie. Il lui est toujours intéressant de constater à quel point la perception négative que la plupart des étudiants ont au début du cours se transforme graduellement à mesure que les connaissances qu’ils acquièrent leur font prendre conscience de l’importance que joue le sol pour la biologie, la vie et le bien-être général de la planète. La science du sol s’invite à toutes ses activités d’enseignement sur le terrain. Maxime aime faire prendre conscience aux étudiants à quel point la vie végétale – exprimée dans sa diversité de plantes et d’arbres – et la vie souterraine s’influencent réciproquement. Enfin, sa spécialité en science du sol lui permet de soutenir des étudiants diplômés de plusieurs disciplines de recherche, allant de divers du domaine agricole (bleuets sauvages, camerise, pommes de terre, cultures commerciales, etc.) et forestier pour s’étendre à toute la sphère des sciences de l’environnement. Que trouver de plus stimulant pour un spécialiste ?
David L. Burton, professeur, Département des sciences végétales, alimentaires et environnementales, Faculté d’agriculture, Université de Dalhousie

David Burton porte deux chapeaux : celui de pédologue et celui de professeur au Département des plantes, de l’alimentation et de l’environnement de l’Université Dalhousie. Ses recherches portent sur l’influence de l’environnement sol sur le métabolisme des microorganismes dans tous ses aspects. Ses recherches visent l’étude des processus du cycle de l’azote qui se déroulent dans le sol au regard des impacts créés sur sa fertilité et sur l’environnement en général. Mieux comprendre les facteurs qui gouvernent les processus de ces microorganismes servira dans l’adaptation des systèmes de gestion des terres aux changements climatiques.
Tom Bruulsema, scientifique en chef chez l’International Plant Nutrition Institute (IPNI) Canada

Depuis juillet 2019, Tom Bruulsema est le scientifique en chef de Plant Nutrition Canada. Grâce à ce poste, il peut apporter son soutien aux programmes de gestion des éléments nutritifs de Fertilisant Canada, du Fertilizer Institute et de l’International Fertilizer Association. Avant la dissolution de l’IPNI, il était vice-président des programmes de l’Institut des Amériques et de la recherche à l’échelle mondiale. De 2015 à 2017, il a dirigé le programme Phosphore de l’Institut. M. Bruulsema a été reconnu comme membre de l’American Society of Agronomy, de la Soil Science Society of America et de la Société canadienne d’agronomie. Auparavant, il occupait le poste d’associé de recherche à l’Université du Minnesota (1994) et d’agronome au Comité central mennonite au Bangladesh (1986-1990).
Dans l'utilisation des engrais, les 4B font référence à (1) la bonne source d'engrais, (2) le bon taux d'engrais, (3) le bon moment de l'application de l'engrais et (4) le bon placement de l'engrais pour obtenir une absorption efficace et rapide des nutriments de l'engrais par la culture. L'objectif est de bien nourrir la culture et d'atteindre le rendement économiquement optimal, sans excès.